
分析 有X、Y、Z三种元素,Z与Y可组成化合物ZY3,ZY3溶液遇KSCN呈血红色,为FeCl3,故Z为Fe元素,Y为Cl元素,X2-、Cl-均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素;
(1)Cl元素的最高价氧化物对应水化物的化学式是HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,所形成的溶液具有胶体的性质,氢氧化铁胶体胶粒带正电荷,会发生电泳现象,溶液中含有氯离子,将溶液蒸干促进水解,最终氢氧化铁分解生成氧化铁;
(3)硫单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3,该酸具有强氧化性,将二氧化硫氧化为硫酸,根据转移电子数计算氯元素在氧化物中化合价,判断氧化物化学式,据此书写化学方程式.
解答 解:有X、Y、Z三种元素,Z与Y可组成化合物ZY3,ZY3溶液遇KSCN呈血红色,为FeCl3,故Z为Fe元素,Y为Cl元素,X2-、Y-均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素,
(1)Cl元素的最高价氧化物对应水化物为高氯酸,高氯酸的化学式为:HClO4,
故答案为:HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,反应的离子方程式是Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
a.氢氧化铁胶体具有丁达尔效应,则光束通过该液体时形成光亮的“通路”,故a正确;
b.胶体胶粒带有正电荷,通直流电后,发生电泳现象,负极附近液体颜色加深,故b正确;
c.所得的溶液中含有氯离子,向该液体中加入硝酸银溶液,有沉淀产生,故c错误;
d.HCl易挥发,将该液体加热、蒸干、灼烧后有氧化铁生成,故d正确;
故答案为:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3H+;abd;
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),则该酸为HClO3,SO2与含1.5molHClO3溶液在一定条件下反应,可生成一种强酸为和一种氧化物,该强酸为H2SO4,Cl元素在氧化物中化合价为x,则(5-x)×1.5×6.02×1023=1.5×6.02×1023,解得x=4,故氧化物为ClO2,该反应方程式为:SO2+2HClO3=H2SO4+2ClO2,
故答案为:SO2+2HClO3=H2SO4+2ClO2.
点评 本题考查较为综合,涉及常用化学用语书写、胶体性质、氧化还原反应计算等知识,题目难度中等,注意明确原子结构与元素周期律、元素周期表的关系,(3)中注意利用氧化还原反应规律计算氯元素在氧化物中的化合价.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1KHS溶液中:c(K+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| B. | 常温下,0.1 mol/L 的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③ | |
| C. | 在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现向10mL浓度为0.1 mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大 | |
| B. | 保存Fe(NO3)2溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| C. | 将AlCl3溶液蒸干可得到固体AlCl3 | |
| D. | 向0.1 mol•L-1氨水中加入少量水,pH减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中寻找优良的催化剂 | |
| B. | 由元素周期律HC1O4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 在化工生产中应遵循“绿色化学”的思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )
如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )| A. | 甲中A处通入CH4,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 乙中电解MgCl2溶液的总反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2 | |
| D. | 甲、乙中电解质溶液的pH都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
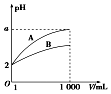 pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )
pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )| A. | 稀释前两酸溶液的物质的量浓度相等 | |
| B. | 稀释后,HA酸溶液的酸性比HB酸溶液强 | |
| C. | a=5时,HA是强酸,HB是弱酸 | |
| D. | 若有等浓度的NaA溶液和NaB溶液,则溶液的碱性NaA>NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的蛋白质均可通过颜色反应来鉴别 | |
| B. | 淀粉和纤维素表达式为(C6H10O5)n,互为同分异构体 | |
| C. | 糖类、油脂、蛋白质均有C、H、O三种元素组成 | |
| D. | 油脂在碱性条件下水解生成甘油和高级脂肪酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
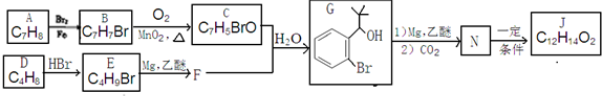
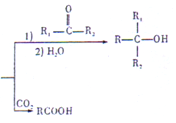
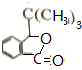 .
.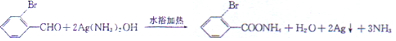
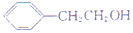 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为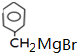 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com