
一定条件下,反应室(容积恒定为2L)中有反应:A(g)
+2B(g) C(g)
C(g)
(1)能说明上述反应达到平衡状态的是 (选填字母)。
A.反应中A与B的物质的量浓度之比为1︰2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2υ正(A)= υ逆(B)
(2)该反应平衡常数K的表达式:K= 。
(3)1molA(g)与2molB(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如下图所示,则:

①P1 P2 , 正反应的△H 0(填“<”、“>”或“=”)。
②下列措施中一定能使c(C)/c(A)增大的是 (选填编号)。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(4)100℃时将1mol A和2molB通入反应室,保持温度不变,10min末C(g) 的浓度为0.05mol/L ,则10min末B转化率= ,此时υ正 υ逆
(填“<”、“>”或“=”)。
(11分)
(1)BD(2分)
(2)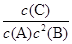 (2分)
(2分)
(3)① <(1分) <(1分) ② CD(2分)
(4)10%(2分) >(1分)
【解析】
试题分析:⑴A.反应中A与B的物质的量浓度之比为1︰2 ,但随时间的变化,它们的物质的量浓度在变化,则不是平衡状态,A错误;B、因该反应是物质的量在减少的化学反应,则混合气体的总物质的量不随时间的变化而变化,达到平衡状态,B正确;C、混合气体的质量、体积一直不变,则密度始终不变,不能作为判断平衡的依据,C错误;D、平衡时正逆反应速率相等,由化学反应中反应速率之比等于化学计量数之比,则υ正(A): υ逆(B)=1:2,即2υ正(A)= υ逆(B),D正确,选BD。
⑵平衡常数K的表达式:K=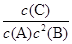 ,答案:
,答案: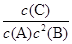 。
。
⑶①A(g) +2B(g)
 C(g)
是气体体积缩小的反应,同一温度,P2时A的转化率大,压强大,P1<P2 ,压强相同时,温度升高,A的转化率降低,平衡逆向移动,正向放热,△H<0;②A、温度升高,A的转化率降低,平衡逆向移动,c(C)/c (A)减小;B、恒温恒容再充入A,平衡正向移动,c(C)/c (A)减小;C、恒温恒容再充入B ,平衡正向移动,c(C)增大,c (A)减小,c(C)/c (A)增大;D、恒温恒容再充入1 mol C,c(C)增大,c (A)增大的量少,c(C)/c (A)增大。选C D。
C(g)
是气体体积缩小的反应,同一温度,P2时A的转化率大,压强大,P1<P2 ,压强相同时,温度升高,A的转化率降低,平衡逆向移动,正向放热,△H<0;②A、温度升高,A的转化率降低,平衡逆向移动,c(C)/c (A)减小;B、恒温恒容再充入A,平衡正向移动,c(C)/c (A)减小;C、恒温恒容再充入B ,平衡正向移动,c(C)增大,c (A)减小,c(C)/c (A)增大;D、恒温恒容再充入1 mol C,c(C)增大,c (A)增大的量少,c(C)/c (A)增大。选C D。
⑷
A(g) +2B(g)  C(g)
C(g)
C始/mol/L 0.5 1
△c/mol/L 0.05 0.1 0.05
C平/mol/L 0.45 0.9 0.05
B转化率=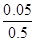 ×100%=10%,
×100%=10%,
100℃时由图,A的转化率为50%时,A、B、C各物质的浓度分别为0.025、0.05、0.025,K=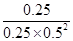 =4,Qc=
=4,Qc=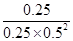 <K,平衡正向移动,此时υ正>υ逆;答案:10%,>。
<K,平衡正向移动,此时υ正>υ逆;答案:10%,>。
考点:化学平衡常数及其计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将 CH3OCH3+H2O
CH3OCH3+H2O CH3OCH3+H2O
CH3OCH3+H2O CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| a2 |
| V2 |
| a2 |
| V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
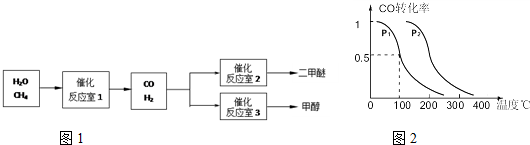
科目:高中化学 来源:2010年江苏省栟茶高中高三模拟考试化学试卷 题型:填空题
(10分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下: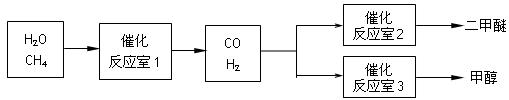
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则: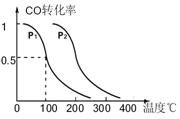
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
查看答案和解析>>
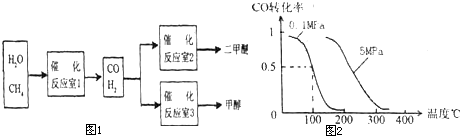
科目:高中化学 来源:2010-2011学年广东省高三下学期二轮复习综合测试(4)理综化学部分 题型:填空题
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
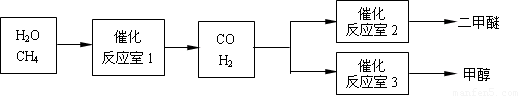
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0。在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=
。
CO(g)+3H2(g) △H>0。在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=
。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
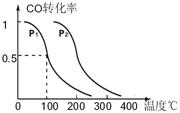
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO
与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g) CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com