
(16分)
I. 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
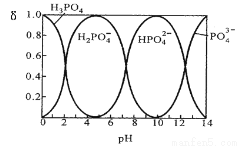
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na3PO4溶液中,c(Na+)/c(PO43—) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
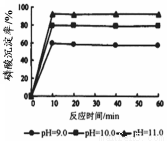
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 。
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:

①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1 ~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
I. ①酸 (1分); H2PO4-在溶液中的电离程度大于水解程度。(1分)
② > (1分), KOH抑制了PO43-的水解(1分);③0.056mmol·/(L·min)(3分)
II. ①4.00×10-4
②如图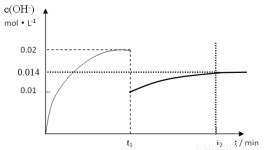 (2分)
(2分) ③
③ 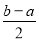 mol/L (2分)
mol/L (2分)
【解析】
试题分析:I. ①根据图示可知H2PO4-存在的溶液的pH是2—7,所以NaH2PO4溶液呈酸性;这说明H2PO4-在溶液中的电离程度大于水解程度。②在Na3PO4溶液中,由于PO43—水解消耗,所以c(Na+)/c(PO43—)>3;向该溶液中滴入几滴浓KOH溶液,由于c(OH-)增大,水解平衡逆向移动,c(PO43-)增大,所以c(Na+)/c(PO43-)的值减小;③在溶液的pH=10.0时,磷酸的沉淀率是80%,由于开始时磷酸的浓度是0.70mol/L,所以磷酸的沉淀速率是V=(0.70mol/L×80%)÷10min=0.056mmol·/(L·min);II. ①求该温度时,氨水的电离平衡常数K K=c(NH4+)?c(OH-)/c(NH3·H2O)=(0.02mol/L×0.02mol/L ) ÷1mol/L=4.00×10-4 mol/L;②②在t1时刻时再加入H2O配成2L溶液,由于浓度减小,所以离子的浓度减小,假如电离平衡不发生移动,则c(OH-)=0.01mol/L,而加水稀释,平衡向电离的方向移动,所以c(OH-)有逐渐增大,到t2时刻时重新达到平衡。由于温度不变,所以电离平衡常数不变,K=c(NH4+)?c(OH-)/c(NH3·H2O)= 4.00×10-4 mol/L,假设平衡时c(OH-)=x,则x2/0.5mol/L= 4.00×10-4 mol/L,所以x=1.4×10-2mol/L=0.014mol/L.在t2时刻时重新达到平衡,在坐标系中画出t1 ~t2时间内OH-浓度随时间变化的曲线为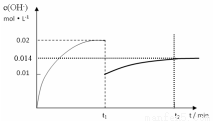 。③若二者等浓度等体积混合,则溶液为NH4Cl溶液,该盐是强酸弱碱盐水解使溶液显碱性,所以若溶液为中性,则应该碱过量,过量的碱电离使溶液的碱性与盐水解是溶液表现的酸性抵消,所以将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=
。③若二者等浓度等体积混合,则溶液为NH4Cl溶液,该盐是强酸弱碱盐水解使溶液显碱性,所以若溶液为中性,则应该碱过量,过量的碱电离使溶液的碱性与盐水解是溶液表现的酸性抵消,所以将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=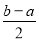 mol/L。
mol/L。
考点:考查溶液的酸碱性与离子的存在的关系、化学反应速率、电离平衡常数的计算、稀释对弱电解质电离平衡的影响的图像法表示及酸碱混合溶液中过量的物质的量浓度的计算的知识。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:填空题
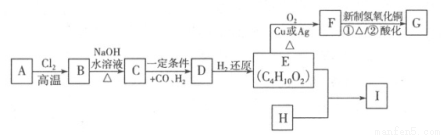
(12分)合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
已知:① R—CH2—CH=CH2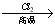 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2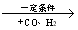 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是 ,E中的官能团的名称是 。
(2)写出A→B的反应方程式 ,该反应类型是 。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出
E+H→I的反应方程式 ,该反应类型是 。
(4)关于G的说法中错误的是 (填序号)。
A.1 mol G最多可与2 mol NaHCO3反应
B.G可发生消去反应
C.1 mol G最多可与2 mol H2发生加成反应
D.1 mol G在一定条件下可与2 mol乙醇发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高一第一学期期中考试化学试卷(解析版) 题型:选择题
两种元素原子X和Y,Y原子的第三层比氩原子的第三层少6个电子,Y原子的第二层电子数恰为X原子第二层电子数的2倍,则X、Y的质子数分别为
A.14和12 B.6和12 C.12和6 D.8和12
查看答案和解析>>
科目:高中化学 来源:2014秋广东省揭阳市高二第一学期期中考试化学试卷(解析版) 题型:选择题
下列概念分类标准正确的是
A.酸和盐:电离时产生的阳离子是否有H+
B.强电解质和弱电解质:溶液导电能力强弱
C.浊液、胶体、溶液:是否具有丁达尔效应
D.氧化剂、还原剂:反应中得失电子的情况
查看答案和解析>>
科目:高中化学 来源:2014秋广东省揭阳市高二第一学期期中考试化学试卷(解析版) 题型:选择题
下列各组物质相互反应时,改变反应的条件或者反应物的物质的量之比,生成的产物不变的是
A.Na与氧气 B.澄清石灰水与二氧化碳
C.KHCO3与Ba(OH)2 D.Al与稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.醋酸钠溶液中滴加酚酞显红色,证明醋酸为弱电解质
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,则该温度下pH=1的盐酸中水电离的c(H+)=1.0×10-12mol/L
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:选择题
下面是一段关于酸碱中和实验操作的叙述:
①取一锥形瓶,用待测NaOH溶液润洗两次。②在一锥形瓶中加入25 mL待测NaOH溶液。③加入几滴石蕊试剂做指示剂。④取一支酸式滴定管,洗涤干净。⑤直接往酸式滴定管中注入标准酸溶液,进行滴定。⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶。⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。文中所述操作有错误的序号为
A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(文)化学试卷(解析版) 题型:选择题
硅单质及其化合物在材料领域中一直扮演着主要角色。下列叙述中,正确的是
A.石英可用来制作工艺品
B.硅单质可用来制造太阳能电池
C.硅单质是制造玻璃的主要原料
D.二氧化硅是制造光导纤维的材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com