
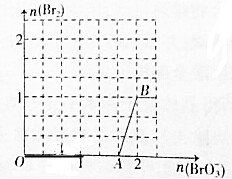
分析 由于还原性HSO-3>Br-,首先发生反应:BrO3-+3HSO3-═Br-+3SO42-+3H+,HSO3-反应完毕,继续加入NaBrO3,由于氧化性BrO-3>Br2,再发生反应:BrO3-+6H++5Br-=3H2O+3Br2,由图可知,A点到B点有Br2生成,应发生BrO3-+6H++5Br-=3H2O+3Br2;当溶液中Br-与Br2的物质的量之比为2:3时,加入的NaBrO3将全部的HSO-3氧化,同时还有一部分KBrO3将Br-氧化为Br2,据此进行计算.
解答 解:由于还原性HSO-3>Br-,首先发生反应:BrO3-+3HSO3-═Br-+3SO42-+3H+,HSO3-反应完毕,继续加入NaBrO3,由于氧化性BrO-3>Br2,再发生反应:BrO3-+6H++5Br-=3H2O+3Br2,由图可知,A点到B点有Br2生成,应发生BrO3-+6H++5Br-=3H2O+3Br2;
根据溶液中Br-与Br2的物质的量之比为2:3,说明有Br2生成,加入的NaBrO3将全部的HSO-3氧化,同时还有一部分NaBrO3将Br-氧化为Br2,那么5L 1mol•L-1NaHSO3溶液中有5molNaHSO3 ,5molNaHSO3中+4价的S会被氧化为+6价,一共失去电子10mol;NaBrO3中+5价的Br,还原为Br-时,设为xmol,每生成1molBr-要得到电子6mol,还原为Br2时,设为y mol,每生成1molBr2,要得到电子10mol;
所以根据得失电子守恒及题意建立关系式:$\frac{x}{y}$=$\frac{2}{3}$ ①,6x+10y=10 ②;解出:x=$\frac{10}{21}$;y=$\frac{5}{7}$;再根据溴原子守恒得到:加入的NaBrO3为x+2y=$\frac{40}{21}$ mol,
故答案为:BrO3-+6H++5Br-=3H2O+3Br2;$\frac{40}{21}$.
点评 本题考查学生对氧化还原反应知识的掌握程度,考查时结合了图象增加了难度,要求学生具有分析和解决问题的能力,特别注意用守恒法可以更好的解决计算问题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl只存在一种空间结构 | |
| B. | CH2Cl2只存在一种空间结构 | |
| C. | CHCl3只存在一种空间结构 | |
| D. | CH4的四个价键的键角和键长都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 植物油和矿物油都是碳氢化合物 | |
| C. | 光导纤维维、合成纤维和玻璃纤维都是新型无机非金属材料 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
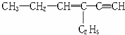 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,6 | B. | 4,3,8 | C. | 2,5,4 | D. | 4,4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
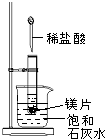 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com