
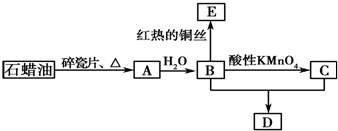
·ÖĪö AŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25g/L£¬ŌņMr£ØA£©=1.25”Į22.4=28£¬ŌņAĪŖCH2=CH2£¬CH2=CH2ÓėĖ®ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¼Ó³É·“Ӧɜ³ÉBĪŖCH3CH2OH£¬CH3CH2OH±»ĖįŠŌĖįŠŌøßĆĢĖį¼ŲŃõ»Æ·“Éś³ÉCĪŖCH3COOH£¬CH3CH2OHŗĶCH3COOHŌŚÅØĮņĖį×÷ÓĆĻĀ·“Ӧɜ³ÉDĪŖCH3COOCH2CH3£¬CH3CH2OH·¢Éś“ß»ÆŃõ»ÆÉś³ÉEĪŖCH3CHO£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗAŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25g/L£¬ŌņMr£ØA£©=1.25”Į22.4=28£¬ŌņAĪŖCH2=CH2£¬CH2=CH2ÓėĖ®ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¼Ó³É·“Ӧɜ³ÉBĪŖCH3CH2OH£¬CH3CH2OH±»ĖįŠŌĖįŠŌøßĆĢĖį¼ŲŃõ»Æ·“Éś³ÉCĪŖCH3COOH£¬CH3CH2OHŗĶCH3COOHŌŚÅØĮņĖį×÷ÓĆĻĀ·“Ӧɜ³ÉDĪŖCH3COOCH2CH3£¬CH3CH2OH·¢Éś“ß»ÆŃõ»ÆÉś³ÉEĪŖCH3CHO£¬
¢ŁA”śBŹĒCH2=CH2ÓėĖ®ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¼Ó³É·“Ӧɜ³ÉCH3CH2OH£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗCH2ØTCH2+H2O $”ś_{¼ÓČČ¼ÓŃ¹}^{“߻ƼĮ}$CH3CH2OH£¬
¢ŚB+C”śDŹĒŅŅĖįÓėŅŅ“¼·¢Éśõ„»Æ·“Ӧɜ³ÉŅŅĖįŅŅõ„£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗCH3COOH+CH3CH2OH $”ś_{”÷}^{ÅØH_{2}SO_{4}}$CH3COOCH2CH3+H2O£¬Ņ²ŹōÓŚČ”“ś·“Ó¦£¬
¹Ź“š°øĪŖ£ŗCH2ØTCH2+H2O $”ś_{¼ÓČČ¼ÓŃ¹}^{“߻ƼĮ}$CH3CH2OH£¬¼Ó³É·“Ó¦£»CH3COOH+CH3CH2OH $”ś_{”÷}^{ÅØH_{2}SO_{4}}$CH3COOCH2CH3+H2O£¬õ„»Æ£ØČ”“ś£©·“Ó¦£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļĶʶĻ”¢ÓŠ»ś·“Ó¦ĄąŠĶ”¢Ķ¬·ÖŅģ¹¹ĢåµČ£¬Éę¼°Ļ©Óė“¼”¢ōČĖįÖ®¼äµÄ×Ŗ»Æ¹ŲĻµµČ£¬ÄŃ¶Č²»“ó£¬×¢Ņā»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
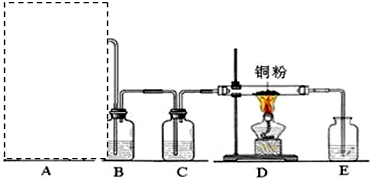
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
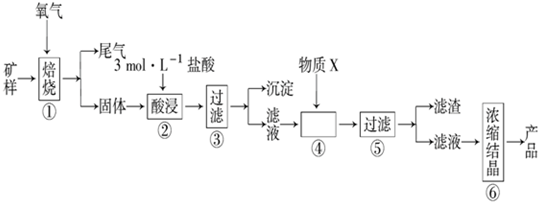
| ½šŹō Ąė×Ó | ĒāŃõ»ÆĪļæŖŹ¼³ĮµķµÄpH | ĒāŃõ»ÆĪļ³ĮµķĶźČ«µÄpH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼Ó³ĪĒåµÄŹÆ»ŅĖ® | B£® | Į½Õß·Ö±šÓėĶ¬ÅØ¶ČµÄĻ”ŃĪĖį·“Ó¦ | ||
| C£® | ČÜÓŚĖ®£¬±Č½ĻĘäČܽāŠŌ | D£® | Į½Õß·Ö±š¼ÓČėNaOHČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2H2£Øg£©+O2£Øg£©=2H2O£Øl£©£»”÷H=-142.9 kJ•mol-1 | |
| B£® | H2£Øg£©+$\frac{1}{2}$O2£Øg£©=H2O£Øl£©£»”÷H=-285.8 kJ•mol-1 | |
| C£® | 2H2+O2=2H2O£»”÷H=-571.6 kJ•mol-1 | |
| D£® | H2£Øg£©+$\frac{1}{2}$O2£Øg£©=H2O£Øg£©£»”÷H=-285.8 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
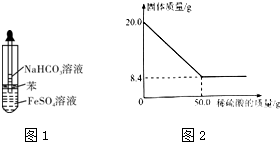
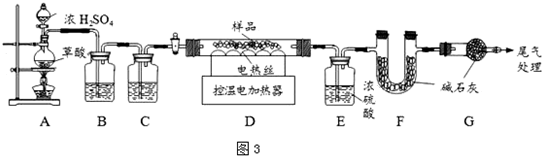
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øł¾Ż·ÖÉ¢ĻµŹĒ·ń¾ßÓŠ¶”“ļ¶ūĻÖĻ󽫷ÖÉ¢Ļµ·ÖĪŖČÜŅŗ”¢½ŗĢåŗĶ×ĒŅŗ | |
| B£® | øł¾ŻĖį·Ö×ÓÖŠŗ¬ÓŠµÄĒāŌ×ÓøöŹżæɽ«Ėį·ÖĪŖŅ»ŌŖĖį”¢¶žŌŖĖį”¢ČżŌŖĖįµČ | |
| C£® | Ć¾ĀĮŗĻ½š”¢ĘÆ°×·Ū”¢Ė®²£Į§”¢ĶõĖ®¾łĪŖ»ģŗĻĪļ | |
| D£® | “æ¼ī”¢ŹģŹÆ»Ņ”¢“×Ėį”¢Ź³ŃĪĖ®¾łĪŖµē½āÖŹ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com