原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是
H
H
(2)X与W组成的化合物中存在
共价
共价
键(填“离子”“共价”).
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
.
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式
.
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl
2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为
(NH4)2Fe(SO4)2?6H2O
(NH4)2Fe(SO4)2?6H2O
.
②已知1mol?L
-1 100mL B的溶液能与1mol?L
-1 20mLKMnO
4溶液(硫酸酸化)恰好反应.写出反应的离子方程式
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
.

 第1卷单元月考期中期末系列答案
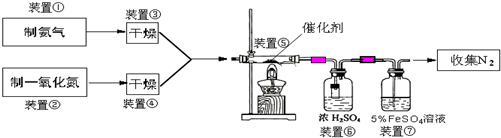
第1卷单元月考期中期末系列答案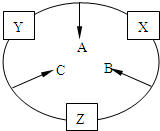 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子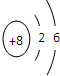
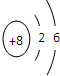
 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-



 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+