
已知Na2SO3固体与硫酸可发生反应:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,下图是实验室制取SO2并验证SO2的某些性质的装置图。试回答: [
[
(1)①中的实验现象为紫色石蕊试液_________________,此实验证明SO2是________气体。
(2)②中的品红溶液___________________,证明SO2有__________性。
(3)③中的实验现象是_________________,证明SO2有__________性。
(4)④中的实验现象是_________________,证明SO2有__________性。
(1)变红,酸性
(2)褪色(或退色),漂白
(3)变浑浊(生成沉淀),氧化
(4)紫红色退去,还原
解析试题分析:(1)、SO2是酸性氧化物,石蕊试液中通入SO2时,SO2与H2O化合生成H2SO3,H2SO3电离出H+,使紫色石蕊变红,说明SO2是酸性气体;(2)、SO2通入品红溶液时,品红溶液褪色,说明SO2具有漂白性;(3)、SO2通入H2S溶液时,溶液变浑浊,生成黄色沉淀,硫元素由+4价降为0价,被还原,说明SO2是氧化剂,具有氧化性;(4)、SO2通入酸性高锰酸钾溶液时,溶液的紫红色褪去,硫元素由+4价升为+6价,被氧化,说明SO2是还原剂,具有还原性。
考点:考查二氧化硫的制取、性质、尾气处理实验等相关知识。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:实验题
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 | 实验现象 |
| I.检验装置的气密性 | |
| II.…… | |
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景。某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)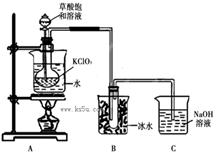
已知信息:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃。与碱反应和氯气相似。
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。
(1)制备ClO2的化学方程式:2KClO3+H2C2O4= 2KHCO3+2ClO2↑;下列说法正确的是
| A.KClO3在反应中得到电子 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中失去电子 |
| D.1mol KClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
二氧化硫是一种大气污染物,研究对NO2、SO2、CO等大气污染气体的处理有重要意义,某化学实验爱好小组欲探究SO2的性质,设计如下方案: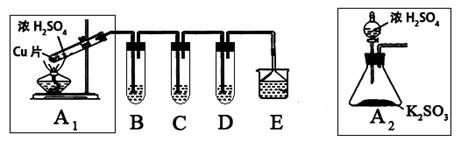
(1)B、C、D分别用于检验SO2的还原性、氧化性和漂白性。其中B、C分别为碘水和硫化氢的水溶液,则D中所盛试剂为_________,B中反应的离子方程式为:_________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 ___________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:_______ _______________________ ___________________________________________________ | _________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题。
(1)在甲、乙两个烧杯中,分别装入40mL浓度均为2mol·L-1的稀硫酸和稀硝酸,并向其中各加入 4g束状铜丝,观察现象,试完成下列实验报告: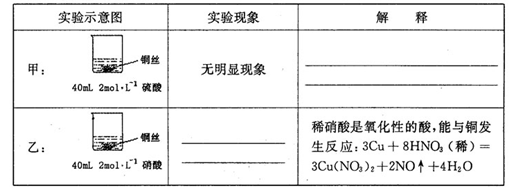
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为____ ,剩余固体总质量为 g
(3)若甲中硫酸溶液体积V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=____ mL,若要将溶液中的Cu2+沉淀完全,应加NaOH使溶液的pH至少为____ 。已知KsP[Cu(OH)2]=2.2×l0-20,1g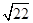 =0.7)
=0.7)
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解? 试写出推理过程________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。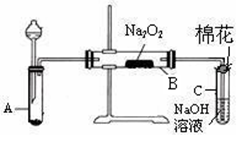
回答下列问题:
(1)制取SO2的合适试剂是 。
a.80%的H2SO4(aq) b.10%的H2SO4(aq)
c.Na2SO3(s) d.Na2SO3(aq)
(1)装置C中NaOH(aq)的作用是 。
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(1)检验反应后B装置中生成物的方法是 。
(1)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。按照乙同学的观点,该装置还需作如下改进: 。(简要阐述,并指明必需的装置名称与试剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。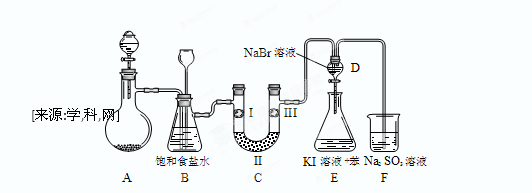
(1)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。
| | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B、C、D之间的转化关系A + B → C + D,下列说法不正确的是( )
A.若A为Fe,D为氢气,则B可能是酸,也可能是水
B.若A、D为化合物,B为水,则C可能是气体单质,也可能是化合物
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D
常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )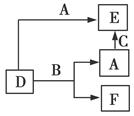
A.D、E中一定都含有甲元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com