
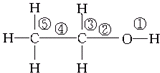
| A. | 与金属钠反应,键①断裂 | |
| B. | 在Ag或Cu催化作用下和O2反应,键②和键③断裂 | |
| C. | 和浓硫酸共热,在170℃时发生消去反应时键②和⑤断裂 | |
| D. | 乙醇和乙酸在浓硫酸作用下加热时发生反应,键①断裂 |
分析 A.醇和钠反应时醇羟基上O-H键断裂;
B.醇发生催化氧化时,连接醇羟基碳原子上的C-H键和醇羟基中O-H键断裂;
C.乙醇发生消去反应时,连接醇羟基碳原子相邻碳原子上C-H键和C-O键断裂;
D.乙醇和乙酸发生酯化反应时,醇羟基上O-H键断裂.
解答 解:A.醇和钠反应时醇羟基上O-H键断裂,即键①断裂,故A正确;
B.醇发生催化氧化时,连接醇羟基碳原子上的C-H键和醇羟基中O-H键断裂,即键①和键③断裂,故B错误;
C.乙醇发生消去反应时,连接醇羟基碳原子相邻碳原子上C-H键和C-O键断裂,即键②和⑤断裂,故C正确;
D.乙醇和乙酸发生酯化反应时,醇羟基上O-H键断裂,即即键①断裂,故D正确;
故选B.
点评 本题以乙醇为载体考查有机物结构和性质,为高频考点,明确有机物反应类型及断键和成键方式是解本题关键,掌握乙醇发生反应断键位置,题目难度不大.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.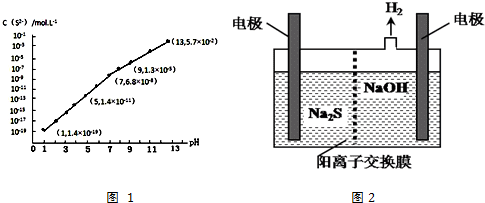
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | NaClO | C. | Ca(ClO)2 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、S2-、Cl- | B. | H+、Na+、I-、NH${\;}_{4}^{+}$ | ||
| C. | K+、Ba2+、OH-、NO${\;}_{3}^{-}$ | D. | Na+、Cl-、SO${\;}_{4}^{2-}$、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com