
| A. | C的简单离子还原性大于D | |
| B. | D元素只能以化合态存在于自然界中 | |
| C. | A元素所形成离子的半径有可能大于He原子的半径 | |
| D. | B、D的原子不能相互结合形成化合物 |
分析 A是元素周期表所有元素中原子半径最小的,则A为H元素;B中一层电子数是另一层的两倍,则B为C元素;C中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素,结合对应元素的性质以及周期率知识解答该题.
解答 解:A是元素周期表所有元素中原子半径最小的,则A为H元素;B中一层电子数是另一层的两倍,则B为C元素;C中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素,
A.非金属性O>S,元素的非金属性越强,对应的阴离子的还原性越弱,故A错误;
B.火山喷口附近有单质硫,故B错误;
C.H-离子与He具有相同的核外电子排布,核电荷数越大,离子半径越小,故C正确;
D.B、D的原子可形成CS2,故D错误.
故选C.
点评 本题考查原子结构与元素周期律的关系,为高考常见题型,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:0.1 mol•L-1 FeCl3溶液与0.3 mol•L-1 NaOH溶液等体积混合 | |
| B. | 验证溴原子:取C2H5Br少许与NaOH溶液共热,冷却后滴加AgNO3溶液 | |
| C. | 检验Fe2+:取少量待测液,向其中加入适量新制氯水,再滴加KSCN溶液 | |
| D. | 比较AgCl和AgI的溶解度:向2 mL 0.1 mol•L-1 NaCl溶液中滴加数滴同浓度AgNO3溶液,然后再滴入KI溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,氧元素氧化了硫元素 | |
| B. | 该反应从电子转移角度看,每生成6 molCu,转移电子12 mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应从电子转移角度看,与SO2+2H2S=3S↓+2H2 O是同一反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下,与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
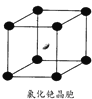 从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质.
从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质.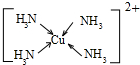 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
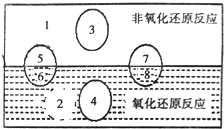 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
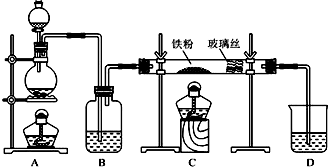
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com