
 (g)→
(g)→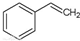 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol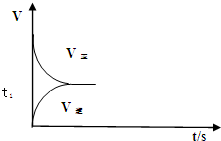
分析 I.(1)根据盖斯定律,结合已知方程式计算反应热,然后写热化学方程式;方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大;
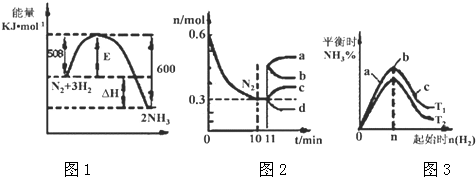
Ⅱ.(3)①由图象1分析,反应是放热反应,依据化学方程式和能量变化分析计算放出热量,依据影响平衡常数因素和平衡移动原理分析;
(4)分析图象变化量,计算氮气的反应速率,结合反应速率之比等于系数之比计算得到氢气速率,依据化学反应速率概念计算得到,缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
(5)图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大;
由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,据此解答;
解答 解:(1)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g)△H=+41.2kJ/mol;
反应②: (g)→
(g)→ (g)+H2(g)△H=+117.6kJ/mol;
(g)+H2(g)△H=+117.6kJ/mol;
根据盖斯定律:①+②,得 CO2(g)+ +CO(g)+H2O(g) △H=+41.2+117.6=+158.8kJ/mol,
+CO(g)+H2O(g) △H=+41.2+117.6=+158.8kJ/mol,
反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1•K2,
故答案为:CO2(g)+ +CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: ,故答案为:
,故答案为: ;
;
Ⅱ.(3)N2(g)+3H2(g)?2NH3(g),反应的焓变△H=-(600KJ/mol-508KJ/mol)=-92KJ/mol;图2分析可知反应进行的氮气的起始量为0.6mol,反应过程中消耗氮气物质的量为0.3mol,依据热化学方程式计算得到反应过程中放热=92KJ/mol×0.3mol=27.6KJ;
图象1分析可知反应是放热反应,反应物能量高于生成物能量,温度升高平衡逆向进行,平衡常数减小,故答案为:减小;
(4)图象分析2L的密闭容器中,V(N2)=$\frac{1}{3}$V(H2)=$\frac{\frac{0.6mol-0.3mol}{2L}}{10min}$=0.015mol/L•min,V(H2)=0.045mol/L•min;
从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,瞬间氮气物质的量不变,随平衡正向进行,氮气物质的量减小,则n(N2)的变化曲线d符合;
故答案为:0.045mol/L•min;d;
(5)图3表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于平衡状态,故a、b、c都处于平衡状态,达平衡后,增大氢气用量,氮气的转化率增大,故a、b、c三点中,c的氮气的转化率最高;
由图3可知,氢气的起始物质的量相同时,温度T1平衡后,氨气的含量更高,该反应为放热反应,降低温度平衡向正反应移动,故温度T1<T2,温度越高化学平衡越低,故K1>K2;
故答案为:c;<.
点评 本题考查热化学方程式书写,化学平衡影响因素分析判断,图象分析方法应用等知识,综合性较大,难度中等,是对知识的综合运用,需要学生具有扎实的基础知识.


科目:高中化学 来源: 题型:选择题
| A. | 用核磁共振氢谱不能鉴别1-丙醇和2-丙醇 | |
| B. | 实验证实 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | 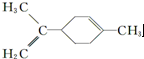 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. | 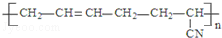 的单体是CH3-C≡C-CH3和CH2═CH-CN 的单体是CH3-C≡C-CH3和CH2═CH-CN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与TiCl4溶液反应,可以置换出金属钛 | |
| B. | 氢氧化铝具有弱碱性,可用于做胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

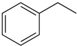
| A. | 该有机物属于芳香烃 | |
| B. | 该物质不能使酸性高锰酸钾溶液褪色 | |
| C. | 该分子对称性好,所以没有顺反异构 | |
| D. | 该有机物分子中,最多可能有18个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:氯化铝溶液 Y:氨气 | |
| B. | X:氢氧化铁胶体 Y:氯化氢 | |
| C. | X:澄清石灰水 Y:二氧化碳 | |
| D. | X:四羟基合铝酸钠溶液 Y:氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
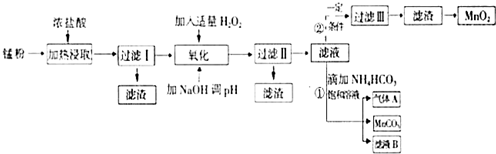 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时PH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4 L的H2O中含有的分子数为NA | |
| B. | 7.8g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 46克 Na与足量氧气反应转移的电子数为2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的钠离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验目的 |
| A.测定等物质的量浓度的 CH3COONa和Na2S溶液pH | 比较 CH3COOH和H2S的酸性强弱 |
B.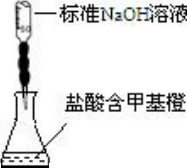 | 测定盐酸的浓度 |
C. | 测定中和热 |
| D.先用酚酞,后用甲基橙作指示剂,用标准盐酸滴定0.1 mol/L的Na2CO3溶液 | 证明 CO32-水解分两步 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com