
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 1mol/L的Mg(NO3)2溶液中含有的NO3-的数目为2 NA | |
| C. | 铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA | |
| D. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
分析 A.该甲基中含有8个中子,17g该甲基的物质的量为1mol,含有8mol中子;
B.溶液的体积不知,只有浓度无法计算微粒数;
C.铁和氯气点燃条件下充分反应,反应生成氯化铁,电子转移根据反应的氯气来计算;
D.因为乙烯和丙烯的实验式为CH2,可以将混合气体转换为单一的气体(CH2)n,然后计算.
解答 解:A.常温常压下,17g甲基(-14CH3)的物质的量=$\frac{17g}{17g/mol}$=1mol,1mol该甲基中含有中子=1mol(14-6+1-1)=8mol,所含的中子数为8NA,故A错误;
B.1mol/L的Mg(NO3)2溶液中含有的NO3-的浓度为2mol/L,但溶液体积不知,不能计算硝酸根离子的微粒数,故B错误;
C.铁与0.1mol氯气在点燃条件下充分反应生成氯化铁,依据反应的氯气计算转移的电子数=0.1mol×2×NA=0.2NA ,故C错误;
D.因为乙烯和丙烯的实验式为CH2,可以将混合气体转换为单一的气体(CH2)n,n(C)=$\frac{42g}{14g/mol}$×n=3mol,混合气体中含有的碳原子数为3NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 0.1mol的CaC2中含阴离子数是0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO${\;}_{3}^{-}$和CO${\;}_{3}^{2-}$离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
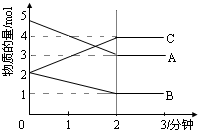 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | C. | 催化剂 | D. | 溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径W>X>Y | B. | W2Y的电子式为: | ||
| C. | 元素的金属性W<X | D. | W2Y2中既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
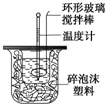 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com