
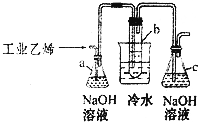
 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br分析 (1)乙烯中含有少量硫化氢,硫化氢能够与溴发生反应,所以应用氢氧化钠除去;
(2)乙烯与溴加成生CH2Br-CH2Br;
(3)CH2Br-CH2Br熔点低,用冷水冷却使其转化为固体;
(4)根据乙烯与溴反应的利用率减少的可能原因进行解答.
解答 解:(1)乙烯中含有少量硫化氢,硫化氢能够与溴发生反应,所以应用氢氧化钠除去,所以氢氧化钠溶液的作用为:除去乙烯中带出的酸性气体;
故答案为:除去乙烯中带出的酸性气体;
(2)乙烯与溴加成生CH2Br-CH2Br,化学方程式:CH2=CH2+Br2→CH2BrCH2Br;属于加成反应;
故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应;
(3)CH2Br-CH2Br熔点低,用冷水冷却使其转化为固体;
故答案为:使溴乙烷转化为固体;
(4)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应,
故答案为:乙烯发生(或通过液溴)速度过快.
点评 本题考查了溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
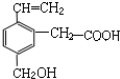
| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:4 | B. | 2:1:3 | C. | 3:4:2 | D. | 4:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g S8单质中含有的S-S键个数为6.02×1023 | |
| B. | 12.4g白磷中含有磷原子数为0.4NA | |
| C. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| D. | 0.1mol OH-含NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作钡餐,Ba2+ 对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱的多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物鉴定,${\;}_{\;}^{12}$C与${\;}_{\;}^{12}$C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
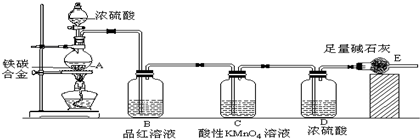
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
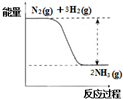 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com