
分析 把0.1mol/L的HCl滴入0.1mol/L的NH3•H2O中.
①显中性时,溶液中c(H+)=c(OH-),据此分析c(NH4+)和c(Cl-)的关系;
②等体积混合时,HCl和NH3•H2O恰好完全反应,所得溶液为NH4Cl溶液,水解显酸性,据此分析;
③盐酸体积为氨水体积一半时,所得溶液为等浓度的NH4Cl和NH3•H2O的混合溶液,根据电离大于水解的规律可知,溶液显碱性,据此分析离子浓度.
解答 解:把0.1mol/L的HCl滴入0.1mol/L的NH3•H2O中.
①显中性时,溶液中c(H+)=c(OH-),而根据电荷守恒可知,c(NH4+)=c(Cl-),故溶液中离子浓度关系为c(NH4+)=c(Cl-)>c(H+)=c(OH-),
答:溶液显中性,离子浓度关系为:c(NH4+)=c(Cl-)>c(H+)=c(OH-);
②等体积混合时,HCl和NH3•H2O恰好完全反应,所得溶液为NH4Cl溶液,水解显酸性,故有:c(H+)>c(OH-),根据溶液的电荷守恒可知,c(Cl-)>c(NH4+),即有:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
答:溶液显酸性,离子浓度大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
③盐酸体积为氨水体积一半时,所得溶液为等浓度的NH4Cl和NH3•H2O的混合溶液,根据电离大于水解的规律可知,溶液显碱性,故有:c(OH-)>c(H+),
由于电离大于水解,故:c(NH4+)>c(Cl-),故溶液中的离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
答:溶液显碱性,离子浓度关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查了酸碱混合后离子浓度的大小比较和溶液的酸碱性,应把握住在浓度相等的盐和对应的酸(或碱)溶液中,一般认为酸(或碱)的电离程度大于对应盐的水解程度.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 高级脂肪酸甘油酯相对分子质量很大,属于高分子化合物 | |
| B. | 缩聚反应的单体至少有两种物质 | |
| C. | 线性高分子的长链上可以带支链 | |
| D. | 电木具有热塑性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
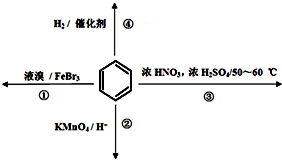
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com