
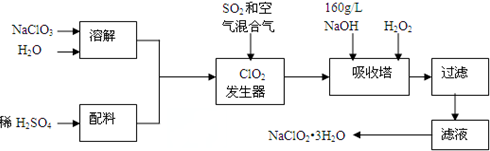
分析 ClO2在二氧化硫和空气混合气体中被稀释,以防止ClO2爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)因通入二氧化硫,二氧化硫具有还原性,可与NaClO3发生氧化还原反应,通入空气,可起到稀释的作用,防止ClO2爆炸;
(2)二氧化硫和氯酸钠发生氧化还原反应生成ClO2,反应时应降低ClO2浓度,防止爆炸;
(3)采取蒸发、浓缩、冷却结晶方法从溶液中得到含结晶水的晶体;
(4)①用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,用淀粉为指示剂,滴定终点,溶液变为无色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,结合反应的关系式计算该题.
解答 解:ClO2在二氧化硫和空气混合气体中被稀释,以防止ClO2爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)因通入二氧化硫,二氧化硫具有还原性,可与NaClO3发生氧化还原反应,离子方程式为2ClO3-+SO2=2ClO2+SO42-,通入空气,可起到稀释的作用,防止ClO2爆炸,
故答案为:2ClO3-+SO2=2ClO2+SO42-; c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.
H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;防止H2O2分解;
(3)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为蒸发浓缩、冷却结晶、过滤,
故答案为:蒸发浓缩、冷却结晶、过滤;
(4)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
故答案为:滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为$\frac{\frac{1}{4}××90.5cV×10{\;}^{-2}g}{mg}$×100%=$\frac{22.625cV}{m}$%;
故答案为:$\frac{22.625cV}{m}$%.
点评 本题物质的制备以及含量的测定,为高考常见题型,题目以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考查以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
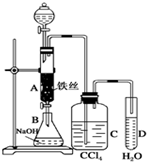 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
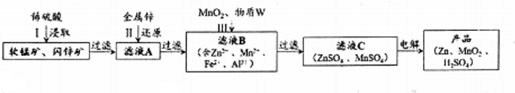
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH${\;}_{4}^{+}$、Ca2+ |
| 阴离子 | OH-、NO${\;}_{3}^{-}$、I-、HCO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、HSO${\;}_{4}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
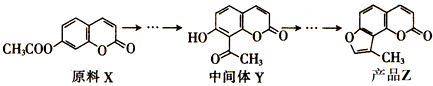
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,Z中的苯环能与Cl2发生取代反应 | |
| D. | Z中所有不饱和键均能与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
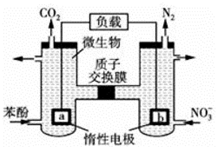
| A. | a电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| B. | 电子流向为a→负载→b→质子交换膜→a | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 当有1mol电子转移时,正极产生2.24L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| B. | 一定量的浓硫酸与Xg Zn反应,若转移的电子为0.4 mol,则参加反应的硫酸分子数目一定等于0.4NA | |
| C. | 高温下,16.8g Fe与足量水蒸气反应,转移的电子数为0.7NA | |
| D. | 向含有0.2 mol FeCl3的两份溶液中分别滴加过量Na2S、通入过量H2S气体,则产生的沉淀比为:$\frac{0.3{N}_{A}}{0.1{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
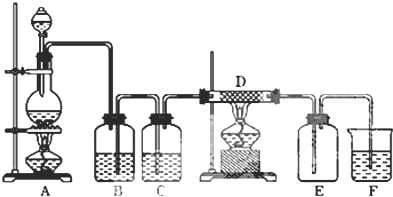
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com