
| A. | H++OH-═H2O△H=-57.3kJ•mol-1 | |
| B. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1 | |
| C. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=-11036kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-5518kJ•mol-1 |
分析 热化学方程式是表示化学反应与反应热关系的方程式.书写和应用热化学方程式时必须注意以下几点:①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数.②各物质化学式右侧用圆括弧( )表明物质的聚集状态.可以用g、l、s分别代表气态、液态、固态.溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液.③反应热与反应方程式相互对应.若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同.④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略,
A、书写热化学方程式必须标注物质的状态.
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,书写热化学方程式时要注意计量数和反应热成比例变化.
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,定义要点:可燃物完全燃烧生成稳定氧化物,如C→CO2,H2→H2O(液),S→SO2(气)等
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,书写热化学方程式时要注意计量数和反应热成比例变化.
解答 解:A、书写热化学方程式必须标注物质的状态,正确的应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,故A错误.
B、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,故当生成2mol水时要放热114.6 kJ,故B正确.
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,生成的水必须为液态,故C错误.
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,由于101KPa时的辛烷的燃烧热为5518kJ/mol,故当2molC8H18燃烧时,反应热为-11036kJ/mol,故D错误.
故选B.
点评 本题考查了中和热、燃烧热的概念应用,注意概念的内涵理解和掌握热化学方程式的书写方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
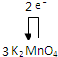 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜晶体、雾 | B. | 水煤气、氢氧化铁胶体 | ||
| C. | 盐酸、磷酸钙 | D. | 玻璃、含Fe为70%的氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2 mol SO3含有的氧原子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32-)=1 mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$═10-10mol/L的溶液中:Na+、HCO3-、Cl-、K+ | |
| C. | 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
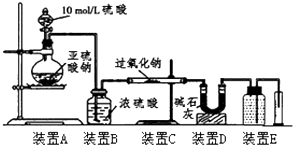
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<$\frac{7{m}_{1}}{30}$或m1>$\frac{30V}{7}$ |
| 未被氧化 | V=$\frac{7{m}_{1}}{30}$或m1=$\frac{30V}{7}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用乙醇汽油作为汽车的燃料 | |
| B. | 洗涤衣物时使用无磷洗衣粉等洗涤剂 | |
| C. | 尽量减少塑料购物袋的使用 | |
| D. | 加大石油、煤炭的开采速度,增加化石的供应量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸均具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com