
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到热饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | “侯氏制碱法”过程中制取NaHCO3 | 将过量CO2通入到NH3和食盐的饱和溶液中 |
| D | 证明CH3COOH是弱酸 | 将CH3COOH与Na2CO3溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaOH浓溶液滴加到热饱和FeCl3溶液中,发生复分解反应生成沉淀;
B.加热促进水解,生成HCl易挥发;
C.过量CO2通入到NH3和食盐的饱和溶液中,生成碳酸氢钠,其溶解度小;
D.CH3COOH与Na2CO3溶液反应,为强酸制取弱酸的反应.
解答 解:A.NaOH浓溶液滴加到热饱和FeCl3溶液中,发生复分解反应生成沉淀,应在沸水中滴加氯化铁溶液制备胶体,故A错误;
B.加热促进水解,生成HCl易挥发,不能蒸干制备,应选冷却结晶法制备,故B错误;
C.过量CO2通入到NH3和食盐的饱和溶液中,生成碳酸氢钠,其溶解度小,则析出碳酸氢钠,故C正确;
D.CH3COOH与Na2CO3溶液反应,为强酸制取弱酸的反应,不能说明醋酸为弱酸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、胶体制备、盐类水解、酸性比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与C形成的化合物溶于水所得溶液显碱性 | |
| B. | B与D形成的化合物溶于水所得溶液显酸性 | |
| C. | 氢化物的稳定性:C>D | |
| D. | 简单离子的半径:B>C>D>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
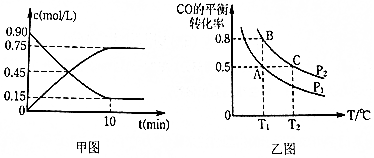
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
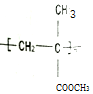 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )| A. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| D. | 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
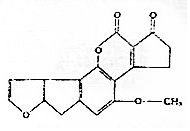 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )| A. | 黄曲霉素分子中所有的原子均共面 | |
| B. | 黄曲霉素分子中含有2个手性碳原子 | |
| C. | 黄曲霉素可以发生取代,加成,氧化反应 | |
| D. | 1mol黄曲霉素最多能与7molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与Ag+浓度有关 | B. | Ag2+也是该反应的催化剂 | ||
| C. | Ag+能降低该反应的活化能和焓变 | D. | v(Cr3+)=v(S2O82-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 最外层电子数Li<Mg<Si<Ar |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com