
 .
. .
. B.
B. 
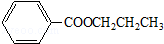
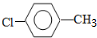 .
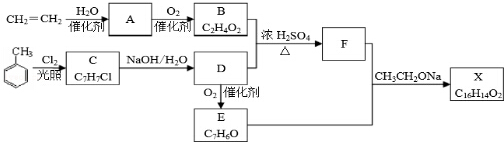
. 分析 乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是乙醇,乙醇催化氧化最终生成乙酸,故B是乙酸;甲苯在光照条件下与氯气发生的是取代反应,则C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为
,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为 ,据此推断得出F为:
,据此推断得出F为: ,那么X为
,那么X为 ,据此结合各小题回答即可.
,据此结合各小题回答即可.
解答 解:乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是乙醇,乙醇催化氧化最终生成乙酸,故B是乙酸;甲苯在光照条件下与氯气发生的是取代反应,则C为 ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为 ,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为
,由D能被氧化为E,且结合给出的信息:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么应E为 ,据此推断得出F为:
,据此推断得出F为: ,那么X为
,那么X为 ,
,
(1)E为苯甲醛,含有官能团为-CHO,即醛基,C→D的反应类型为取代,
故答案为:醛基;取代;
(2)B为乙酸,D为苯甲醇,两者发生酯化反应生成乙酸苯甲酯,化学反应方程式为: ,
,
故答案为: ;
;
(3)E与F形成X,即 与
与 反应生成X,依据信息可知:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么X应为:
反应生成X,依据信息可知:RCHO+CH3COOR′$\stackrel{CH_{3}CH_{2}ONa}{→}$RCH=CHCOOR′,那么X应为: ,
,
故答案为: ;
;
(4)A.X中含有酯基,能发生水解反应,故A正确;
B.X中含有苯环,能与浓硝酸发生取代反应,故B错误;
C.X中含有碳碳双键,能使Br2/CCl4溶液褪色,故C正确;
D.X中不含有醛基,不能发生银镜反应,故D错误,
故选AC;
(5)F为 ,分子式为:C9H10O2,A中含有10个碳原子数,与F不是同分异构体,故A错误;
,分子式为:C9H10O2,A中含有10个碳原子数,与F不是同分异构体,故A错误;
B和C的分子式均为C9H10O3,且与F结构不同,属于同分异构体;D中C原子个数为10,与F不是同分异构体,故D错误,
故选BC;
(6)C为 ,C的同分异构体有多种,其中只有3种氢原子的结构简式为
,C的同分异构体有多种,其中只有3种氢原子的结构简式为 ,
,
故答案为: .
.
点评 本题主要考查的是有机物的合成与有机物的推断,充分掌握常见有机化合物的性质以及抓住所给信息解题是关键,难度中等,注意有机官能团的性质的灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| C. | 盐:胆矾、小苏打、铜绿 | |
| D. | 无丁达尔现象的分散系:碘的四氯化碳溶液、淀粉溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题:
X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题: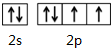 ;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35g | B. | 30g | C. | 20g | D. | 15g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
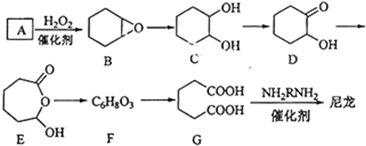
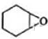 +H2O→
+H2O→ (不需注明条件,其他无机试剂任选).
(不需注明条件,其他无机试剂任选). .
.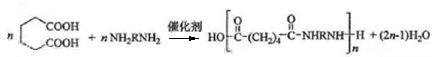 .
.
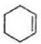 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$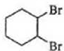 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$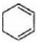 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com