
下图中A~D是中学化学实验中常见的几种温度计装置示意图。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C下的空格中。
①酒精和浓硫酸混合加热制乙烯 ②电石跟水反应制乙炔 ③分离苯和硝基苯的混合物 ④苯与溴的取代反应 ⑤石油的分馏 ⑥浓盐酸与二氧化锰混合加热制氯气 ⑦测定硝酸钾在水中的溶解度 ⑧食盐和浓硫酸混合加热制氯化氢
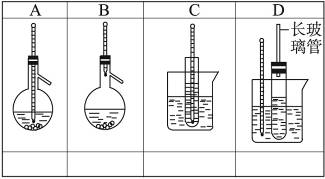
(2)选用D装置做苯的硝化实验,D中长玻璃管的作用是___________________________。
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:

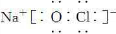
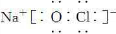
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转换关系如下图所示(部分产物略去)。
(1)若A为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于 分子(填“极性”或“非极性”),B分子中所有原子是否都满足8电子结构, (填“是”或“否”)。
②向50 mL 4 mol/L的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中的溶质为_______(填化学式),物质的量分别为_____________。
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式 。
②写出A和B在溶液中反应的离子方程式 。
(3)若A为常见的金属,在E的冷、浓溶液中有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38mol电子,向D溶液中加入与D等物质的量的固体X,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期12月月考化学试卷(解析版) 题型:填空题
下图是中学化学某些物质之间在一定条件下的相互转化关系,已知A是一种常见的液态化合物, C、D、G、H、K是单质,其它为化合物,G、K是普通钢中的两种重要元素,其中K含量少,E、F对应溶液的酸碱性相反,F的焰色反应为黄色,请按要求作答:

(1)写出化合物J的电子式:_______________。
(2)G3+比G2+的稳定性的原因 ,组成D、H、K三种元素的第一电离能由大到小的顺序为 (写元素符号)。A分子中心原子的杂化方式为 ,A可与Cu2+形成天蓝色的物质,画出该离子的结构示意图 ,写出一种与化合物I 为等电子体关系的阴离子
(3)B与足量稀硝酸反应,当参加反应的硝酸为4mol,转移电子的物质的量为 _________mol(保留2位有效数字)。
(4)已知在200℃,101Kpa下,0.12g单质K与A完全反应生成C与I,吸收了1316 J的能量,写出此反应的热化学方程式:_________________________。
(5)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的电极反应为:___________。
②若用此电池电解300mL 5mol/L的氯化钠溶液一段时间,两极均收集到标准状况下3.36L气体,此时溶液的pH为_________(假设电解前后溶液体积不变化)。
③若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),此时溶液中所有离子浓度的关系由大到小的顺序为:_______________________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(11 分)已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。

请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在元素周期表第三周期中,性质最活泼的金属所形成晶体的堆积模型是 ,配位数为 。
(2)根据VSEPR模型, H2O的立体结构为 形,中心原子的杂化轨道类型是 ;含有8个质子,10个中子的原子的化学符号为_______;周期表中电负性最大的元素为_______;最外层电子排布为4s24p1的原子的核电荷数为________。
(3)下列7种物质:①白磷(P4);②水晶;③氯化铵;④氢氧化钙;⑤氟化钠;⑥过氧化钠;⑦石墨,固态下都为晶体,回答下列问题(填写序号):不含金属离子的离子晶体是________,既含范德华力,又有非极性键的晶体是____,熔化时既要克服范德华力,又要破坏化学键的是___。
(4)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
B.________;D.__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com