【答案】
分析:(1)根据题目所给信息推导出X、Z、W三种元素,由化合物的成键元素来判断化学键类型;
(2)根据盐的水解原理和离子浓度大小比较的方法来回答;
(3)根据盖斯定律和热化学方程式的书写原则来回答;
(4)①根据温度和压强对化学平衡的影响来分析;
②根据平衡常数表达式和该点所示的有关数据进行计算;
③根据压强对化学反应速率的影响来回答;
④提高YZ转化率,平衡向右移动,结合化学平衡移动的影响因素来回答.
解答:解:短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,故X为H,Y是形成化合物种类最多的元素,故Y为C,Z是自然界含量最多的元素,故Z为O,W是同周期中金属性最强的元素,故W为Na,M的负一价离子与Z的某种氢化物分子(应为H
2O
2)含有相同的电子数即18个,故M为Cl,
(1)X、Z、W形成的化合物为NaOH,其中含有的化学键类型为离子键和共价键,故答案为:离子键、共价键;
(2)由Y、Z、W三元素共同构成的化合物为碳酸钠,CO
32-水解显碱性,方程式为:CO
32-+H
2O═HCO
3-+OH
-、HCO
3-+H
2O═H
2CO
3+OH
-,溶液中各个离子浓度的关系遵循电荷守恒,即c(Na
+)+c(H
+)═c(OH
-)+2c(CO
32-)+c(HCO
3-),故答案为:CO
32-+H
2O═HCO
3-+OH
-、HCO
3-+H
2O═H
2CO
3+OH
-;c(Na
+)+c(H
+)═c(OH
-)+2c(CO
32-)+c(HCO
3-);
(3)根据盖斯定律,H
2与Cl
2的反应和①②③之间的关系为①-②+2×③,故反应的热化学方程式为:H
2(g)+Cl
2(g)═2HCl(g);△H=(a+b-2c)KJ?mol
-1,故答案为:H
2(g)+Cl
2(g)═2HCl(g);△H=(a+b-2c)KJ?mol
-1;
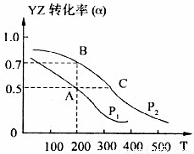
(4)①根据图示,当温度相等时的A、B两点,看出P
2时CO的转化率高于P
1,而压强增大,才可以达到这种结果,故P
2高于P
1,故答案为:小于;
②从图中看出A点时,CO的转化率为0.5,CO+2H
2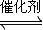
CH
4O,CO的初始浓度为1mol/l,氢气的初始浓度为2mol/l,则CO变化浓度为0.5mol/l,氢气减少的浓度为1mol/l,故平衡时CO、H
2、甲醇的浓度分别为0.5mol/l、1mol/l、0.5mol/l,据K=
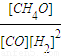
=

=1(mol/l)
-2,故答案为:1(mol/l)
-2;
③因P
2高于P
1,故C点压强大于A点,压强大反应速率快,故反应开始到达平衡状态所需的时间t
A大于t
C,故答案为:大于;
④提高CO转化率,说明平衡向右移动,根据化学平衡移动的影响因素,故可以降温、加压、及时的移走甲醇等,故答案为:降温、加压.
点评:本题是原子结构知识和化学平衡知识相结合的一道综合题目,难度较大,考查学生分析和解决问题的能力.

 CH4O,CO的初始浓度为1mol/l,氢气的初始浓度为2mol/l,则CO变化浓度为0.5mol/l,氢气减少的浓度为1mol/l,故平衡时CO、H2、甲醇的浓度分别为0.5mol/l、1mol/l、0.5mol/l,据K=
CH4O,CO的初始浓度为1mol/l,氢气的初始浓度为2mol/l,则CO变化浓度为0.5mol/l,氢气减少的浓度为1mol/l,故平衡时CO、H2、甲醇的浓度分别为0.5mol/l、1mol/l、0.5mol/l,据K=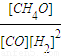 =
= =1(mol/l)-2,故答案为:1(mol/l)-2;
=1(mol/l)-2,故答案为:1(mol/l)-2;

 同步奥数系列答案
同步奥数系列答案