
����Ŀ����MgCl2��AlCl3�Ļ����Һ�У���ʼ�μ��Լ�X��֮��ĵ��Լ�Y�����ó��������ʵ���n(mol)���Լ����V(mL)��Ĺ�ϵ��ͼ��ʾ�����½��۴������(����)
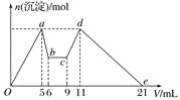
A. X�����ᣬY��NaOH��Һ����c(Y)��2c(X)
B. ԭ���Һ�У�c(Al3��)��c(Mg2��)��c(Cl��)��1��1��5
C. X��NaOH��Һ��Y�����ᣬ��c(NaOH)��c(HCl)��2��1
D. ��7��9��Ӧ�����ӷ���ʽΪH����OH��===H2O
���𰸡�A
������������ͼ���֪�ȼ�����Լ�Xһ��ʼ�Ͳ��������������Լ��ļ�����������ܽ⣬�����Լ�XΪNaOH������������Լ�Y������������������������ļӦ���������Լ�Y��������������ƫ���������ᷴӦ���ɳ���������������ƫ������ȫ��ת��Ϊ�����������ٵ����ᣬ���ܽ�������������������þ�������Լ�YΪ���ᣬ��A���������Ϸ�����֪X���������ƣ�Y�����ᣬA������B�����������Ƶ�Ũ��Ϊ6mol/l���Ӽ���5mLX���ɳ�����࣬�ټ�����1mLX���������ٵ���Сֵ���μ�����������5��6��1 mL��ʱ��Ӧ��Ӧ�����ӷ���ʽΪ��Al��OH��3��+NaOH=NaAlO2+2H2O���ɴ˿�֪��n��Al3+��=n[Al��OH��3]=0.006mol����ǰ5mLNaOH�γ�����������֪��2n��Mg2+��+3n��Al3+��=0.03mol������n��Mg2+��=0.006mol����Һ�������������������ȣ���n��Cl-��=0.03mol������Һ��c(Al3��)��c(Mg2��)��c(Cl��)��1��1��5��B��ȷ��C����ͼ��֪��5��6��1mL��Ϊ�����������ܽ⣬������Ӧ��Al��OH��3��+NaOH=NaAlO2+2H2O��9��11��2 mL��Ϊƫ������ǡ����ȫ����Al��OH��3������������Ӧ��NaAlO2+HCl+H2O=Al��OH��3��+NaCl��������Ԫ���غ�֪��
NaOH��Al��OH��3��AlO2-��H+
1 1 1 1
�ɴ˿����Ƴ���n��NaOH��=n��HCl������Ϊv��NaOH����v��HCl��=1��2�����ԣ�c��NaOH����c��HCl��=2��1��C��ȷ��D����6mL����ԭ���ĵμ�NaOH����Ϊ�μ����ᣬ��ͼ��֪7mL��9mLʱ��ӦҺ���г��������䣬������֪��ʱ������������кͷ�Ӧ����H����OH��===H2O��D��ȷ����ѡA��


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�Է�Ӧ2Fe3++2I��2Fe2++I2Ϊԭ�����о�Ũ�ȶ�������ԭ�Ժ�ƽ���ƶ���Ӱ�죮ʵ����ͼ1��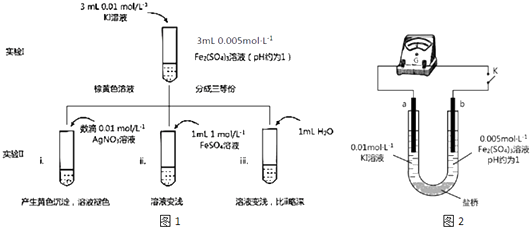
��1����ʵ��I��Һ��ɫ���ٸı�ʱ���ٽ���ʵ��II��Ŀ����ʹʵ��I�ķ�Ӧ�ﵽ ��
��2��iii��ii�ĶԱ����飬Ŀ�����ų���ii����ɵ�Ӱ�죮
��3��i��ii����ɫ�仯����ƽ�������ƶ���Fe2+��Fe3+ת�����û�ѧƽ���ƶ�ԭ������ԭ�� ��
��4������������ԭ��Ӧ�Ĺ��ɣ���ͬѧ�Ʋ�i��Fe2+��Fe3+ת����ԭ �����Ag+ʹc��I�������ͣ�����I���Ļ�ԭ������Fe2+ �� ��ͼ2װ�ã�a��b��Ϊʯī�缫������ʵ����֤����K�պ�ʱ��ָ������ƫת��b������
�ڵ�ָ����㣨��Ӧ�ﵽƽ�⣩����U����ܵμ�0.01molL��1 AgNO3��Һ������������֤ʵ�����Ʋ⣬�������� ��
��5�����գ�4����ԭ������ͬѧ����ͼװ�ý���ʵ�飬֤ʵ��ii��Fe2+��Fe3+ת����ԭ���ת��ԭ���� ��
�ڸ�ʵ���루4��ʵ��Աȣ���ͬ�IJ����� ��
��6��ʵ��I�У���ԭ�ԣ�I����Fe2+����ʵ��II�У���ԭ�ԣ�Fe2+��I�� �� ����3���ͣ�4������5�����Աȣ��ó��Ľ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����������(����)
A. ���ڵ��������� B. ʯī��
C. ϡ���� D. ��̬�Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������þ�����ֱ����Ũ�ȡ�������Ĺ���ϡ���ᷴӦ��������������(V)��ʱ��(t)��ϵ����ͼ�����й��ڷ�Ӧ��˵����������
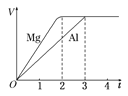
A��þ���������ʵ���֮��Ϊ3��2
B��þ����ת�Ƶ�����֮��Ϊ1��1
C��þ������Ħ������֮��Ϊ8��9
D��þ������Ӧ����ʱ��֮��Ϊ3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ��д�����Mg2����Al3����H����Cl��������OH���������Һ����μ���0.5 mol��L��1NaOH��Һ�����ɳ����������ͼ���NaOH��Һ�����֮��Ĺ�ϵ����ͼ��ʾ������ж�ԭ��Һ��(����)
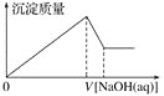
A. ��Mg2����û��Al3��
B. ��Al3����û��Mg2��
C. ��Mg2����Al3��
D. �����H����Mg2����Al3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г������ʵ������뻯ѧʽ���Ӧ���ǣ� ��
A.��ʯ�ҩ�Ca��OH��2
B.С�մ�KHCO3
C.�ؾ�ʯ��CaSO4
D.���ᩁC2H4O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ������ͬϵ����ǣ� ��
�� ![]() ��
�� ![]() ��
�� ![]() ��C2H4 ��CH2=CH��CH=CH2 ��C3H6 ��
��C2H4 ��CH2=CH��CH=CH2 ��C3H6 �� ![]() ��
�� ![]()
A.�ٺ͢�
B.�ܺ͢�
C.�ٺ͢�
D.�ܺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯȼ��ȼ�����ɵ�SO2��O2�Ӵ��Ჿ��ת��ΪSO3����Ӧ��������Ʈ������������ÿ����ǣ� ��
A.����B.��C.��ԭD.����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com