
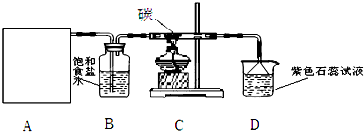
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 氨碱法 | 联合制碱法 | ||
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
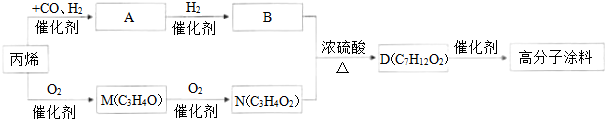
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的分子式为C2H4O3 |
| B、A的结构简式为HO-CH2-COOH |
| C、1 mol A与足量的单质Na反应时放出H2的物质的量为1.0mol |
| D、A分子中的官能团有两种,这两种官能团之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率v(B)=0.25 mol?L-1?min-1 |
| B、该反应方程式中,x=1 |
| C、2min时,A的物质的量为1.5mol |
| D、2min时,A的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com