
| 原子团 | -CH2- | 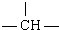 | -CH3 | -NH2 | -OH |
| 个数 | n | m | a | 2 | X |
| A. | m-a | B. | n+m+a | C. | m+2n-a | D. | 2n+3m-a |
分析 有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,以1条碳链分析考虑,先分析若只连接甲基,计算连接的甲基数目,再根据分子中含有的甲基、氨基的数目计算-OH数,1个-CH-可连接1个甲基,-CH2-不管多少个只能连接两个-CH3,据此计算判断.
解答 解:若只连接甲基,-CH2-不管多少个只能连接两个-CH3,m个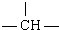 能连接m个-CH3,
能连接m个-CH3,
所以n个-CH2-,m个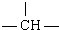 连接-CH3共计m+2个,
连接-CH3共计m+2个,
由于分子中含有a个-CH3和2个-NH2,所以连接的-OH数为:m+2-a-2=m-a,
故选A.
点评 本题考查有机化合物中成键特征,题目难度中等,解答关键是明确有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,试题培养了学生的分析能力及灵活应用能力.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳纤维增强复合材料可用于人体组织中韧带的制作 | |
| B. | 氮化硅陶瓷是新型无机非金属材料 | |
| C. | 银、铜、铁都是有色金属材料 | |
| D. | 碳化硅陶瓷具有压电效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热到100℃,pH=6:c(H+)>c(OH-) | |
| B. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| C. | 0.1mol•L-1 的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 同浓度的三种溶液:①CH3COONH4②NH4Cl③NH3•H2O中,c(NH4+)由大到小的顺序是②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用天然气做燃料可以有效地减少“温室效应”的气体产生 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 可以用浸泡过高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯,达到保鲜目的 | |
| D. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,但不能用福尔马林保鲜鱼肉等食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯能与浓硝酸、浓硫酸反应生成TNT | |
| C. | 苯酚能与FeCl3溶液发生显色反应 | |
| D. | 苯酚具有酸性,能与碳酸钠溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com