
| A. | FeCl2 | B. | Fe3O4 | C. | Al2O3 | D. | CuCl2 |
科目:高中化学 来源: 题型:选择题
| A. | 混合物 | B. | 有机物 | C. | 氧化物 | D. | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
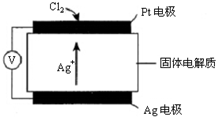 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Ⅰ中S单质是氧化剂 | |
| B. | 反应ⅡAl2O3中Al元素被氧化 | |
| C. | 当生成5.4 g Al时,反应Ⅰ和反应Ⅱ共转移1.2 mol e- | |
| D. | 反应Ⅰ氧化产物与还原产物物质的量之比为2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3═CaO+CO2↑ | B. | NaHCO3+NaOH═Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | D. | 3K2MnO4+2H2O═2KMnO4+MnO2↓+4KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
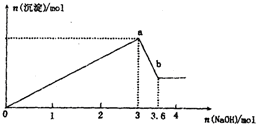 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com