
【题目】计算题:常温下,将20.0g 14%的NaCl溶液与30.0g 24%的NaCl溶液混合,混合后得到密度为1.17g/cm3的溶液.请计算(无解题过程不得分):
①混合后溶液中NaCl的质量分数;
②混合后溶液中NaCl的物质的量浓度;
③在1000g水中加多少 mol NaCl,才能使其浓度恰好与上述混合后溶液的浓度相等(结果保留一位小数).
【答案】解:①将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,混合后溶液的质量为20g+30g=50g,令混合后NaCl的质量分数为ω,则:
50g×ω=20g×14%+30g×24%,解得ω=20%
答:混合后NaCl溶液的质量分数为20%.
②混合后溶液中NaCl的物质的量浓度为 ![]() mol/L=4mol/L,
mol/L=4mol/L,
答:混合后氯化钠溶液的物质的量浓度为4mol/L.
③令需要氯化钠的物质的量为n mol,NaCl的质量为n mol×58.5g/mol=58.5n g,则: ![]() =20%,
=20%,
解得n=4.3,
答:在1000g水中需要加入4.3 mol NaCl.
【解析】①根据m(溶质)=m(溶液)×ω计算溶质的质量,计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氯化钠的质量之和计算混合后溶质氢氧化质量分数;②根据c= ![]() 计算混合液的物质的量浓度;③令需要氯化钠的物质的量为n mol,根据m=nM计算NaCl的质量,利用质量分数相等列方程计算.
计算混合液的物质的量浓度;③令需要氯化钠的物质的量为n mol,根据m=nM计算NaCl的质量,利用质量分数相等列方程计算.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。据此判断,氧化银是:
A.负极,被氧化B.负极,被还原
C.正极,被还原 D.正极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 总质量一定的油脂,无论以何种比例组合,完全水解后生成甘油的量不变
B. 用甘氨酸(![]() )和丙氨酸(
)和丙氨酸( )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
C. 用碳酸钠溶液不能区分乙醇、乙酸、苯和硝基苯四种有机物
D. 苯酚和苯甲醇互为同系物,均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
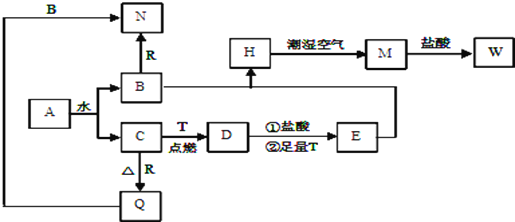
(1)写出下列物质的化学式:D___________ R_________。写出A的电子式 _______ 。
(2)按要求写出下列反应方程式
H在潮湿空气中变为M的化学方程式__________________________________________,
B与R反应的化学方程式 __________________________________________________ ,
Q与B反应的离子方程式____________________________________________________ 。
(3)向沸水中加入W饱和溶液,可制得一种红褐色透明液体,该反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 催化重整是获得芳香烃的主要途径之一
B. 重油的催化裂化主要是为提高轻质油的产量
C. “西气东输”工程中输送的气体主要成分为甲烷
D. 煤经气化和液化等物理变化过程,可变为清洁能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com