
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1.2mol |
| 2mol |
| 0.42×0.42 |
| 0.43×0.8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氟化氢的电子式:H:F |
| B、乙醇的分子式:CH3CH2OH |
C、硫原子的结构示意图: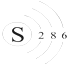 |
| D、Na2O2中即含有离子键,又含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
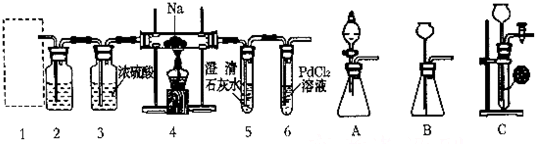
查看答案和解析>>
科目:高中化学 来源: 题型:
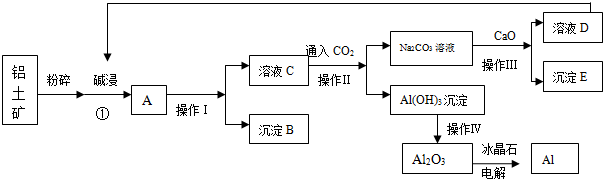
查看答案和解析>>
科目:高中化学 来源: 题型:
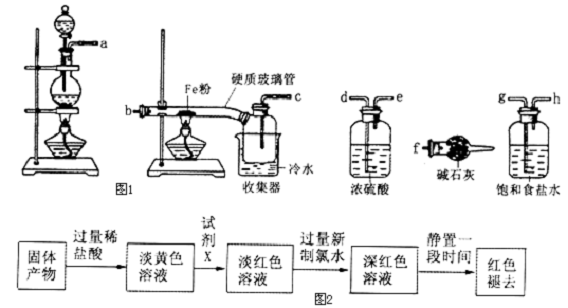
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 0.01mol?L-1 酸性KMnO4溶液 | 0.1mol?L-1 H2C2O4溶液 | 水 | 1mol?L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 1mL | 0 | 20 | 320 | ||
| Ⅲ | 0 | 50 | 30 | |||
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
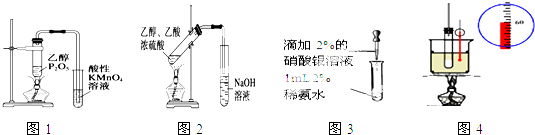
| A、图1可证明乙醇发生消去反应生成了乙烯 |
| B、图2用于实验室制备乙酸乙酯 |
| C、图3用于配制银氨溶液 |
| D、图4用于实验室制硝基苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com