
分析 (1)根据盖斯定律,①×2+②可得目标反应,据此计算出△H4;
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(3)根据化学平衡常数的概念及该反应方程式写出其表达式;
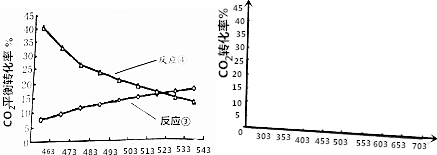
(4)①根据图象可知,升高温度,二氧化碳的转化率增大,则平衡向着正向移动,据此判断焓变;
②根据反应③为吸热反应、反应④为放热反应分析;
③反应④在503K时达到平衡,则在该温度下二氧化碳的转化率最高,据此画出图象.
解答 解:(1)反应①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H1=-49.01kJ/moL
反应②2CH3OH(g)?CH3OCH3(g)+H2O(l)△H2=-24.52kJ/moL,
根据盖斯定律,①×2+②可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)△H4=(-49.01kJ/moL)×2+(-24.52kJ/moL)=-122.54kJ/mol,
故答案为:-122.54kJ/mol;
(2)反应③CO2(g)+H2(g)?CO(g)+H2O(l),
A.v正(H2)=v逆(H2O),正逆反应速率相等,达到了平衡状态,故A正确;
B.n(CO2):n(H2):n(CO):n(H2O)=1:1:1:1,不能证明各组分的浓度不再变化,无法判断是否达到平衡状态,故B错误;
C.由于反应前后气体质量不相等,在恒容条件下,反应过程中混合气体的密度始终发生变化,所以混合气体的密度不变,证明各组分浓度不再变化,已经达到平衡状态,故C正确;
D.反应前后气体混合气体的平均相对分子质量不变,表面各组分浓度不变,该反应已经达到平衡状态,故D正确;
E.该反应是气体体积缩小的反应,若容器的压强不变,说明正逆反应速率相等,已经达到平衡状态,故E正确;
故答案为:B;
(3)2CH3OH(g)?CH3OCH3(g)+H2O的平衡常数表达式为:K=$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{c({C{H}_{3}OH)}^{2}}$,
故答案为:K=$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{c({C{H}_{3}OH)}^{2}}$;
(4)①根据图象可知,升高温度后反应二氧化碳的转化率增大,说明升高温度平衡向着正向移动,则正反应为吸热反应,所以△H3>0,
故答案为:>;
②由于反应③为吸热反应,反应④为放热反应,所以在较低温度下,反应③的平衡转化率较小而反应④较大,故低温对反应④有利,二甲醚的产率较高,
故答案为:低温;较低温度下,反应③的平衡转化率较小而反应④较大,所以低温对反应④有利,二甲醚的产率较高;
③反应④在503K时达到平衡,则从298K开始,二氧化碳的转化率逐渐增大,当温度达到503K时,二氧化碳的转化率达到最大,当温度大于503K后,二氧化碳的转化率会减小,则CO2转化率随温度升高的变化曲线为: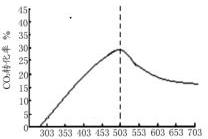 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡状态的判断、化学图象的分析等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及其应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | b-a=n+m | B. | a-b=n-m | C. | 质子数Y>X | D. | 核电荷数Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂金做首饰不能用金属键理论解释 | |
| B. | 固态和熔融时易导电,熔点在1 000℃左右的晶体可能是金属晶体 | |
| C. | Li、Na、K的熔点逐渐升高 | |
| D. | 金属导电和熔融电解质(或电解质溶液)导电的原理一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | ①②④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常利用油脂的碱性水解制取肥皂 | |
| B. | 雾、鸡蛋清水溶液、水与乙醇的混合液均具有丁达尔效应 | |
| C. | 蔬菜汁饼干易氧化变质:建议包装饼干时,加入一小包铁粉作抗氧化剂和吸水剂并密封 | |
| D. | 浸泡过高锰酸钾溶液的硅藻士可以吸收乙烯,所以可用此物保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
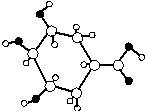
| A. | 该有机物不含苯环 | |
| B. | 分子式为C7H12O4 | |
| C. | 能与NaHCO3溶液反应生成CO2 | |
| D. | 1mol该有机物与足量的金属钠反应产生2molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用带橡皮塞的棕色细口瓶盛放浓硝酸 | |
| B. | 滴定管经蒸馏水润洗后,即可注入标准液进行滴定 | |
| C. | 用干燥清洁的玻璃棒蘸取某溶液点在pH试纸中部,跟标准比色卡比较来测定该溶液的pH | |
| D. | 配制溶液时加水超过容量瓶的标线,用滴管把多余的液体吸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com