
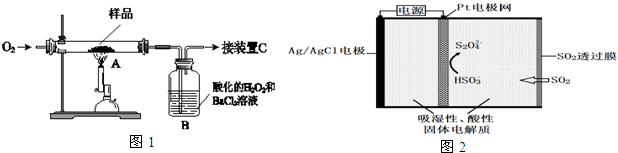
分析 (1)①取m g该中药样品于装置A中,经充分反应,FeS2燃烧生成二氧化硫和氧化铁,二氧化硫通入酸化的过氧化氢和氯化钡溶液中,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,发生氧化还原反应生成硫酸钡沉淀;
②元素守恒分析,需要测定B中沉淀质量计算硫元素物质的量;阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液,说明含有铁和氧化铁;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,依据化学反应的定量关系计算得到.
解答 解:(1)①取m g该中药样品于装置A中,经充分反应,FeS2燃烧生成二氧化硫和氧化铁,二氧化硫通入酸化的过氧化氢和氯化钡溶液中,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,发生氧化还原反应生成硫酸钡沉淀;过氧化氢的主要作用是氧化剂氧化+4价硫为+6价硫酸根离子,装置B中的H2O2反应时表现出了氧化性;
故答案为:氧化;
②欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-,电极反应为2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:B中沉淀的质量;2HSO3-+2H++2e-=S2O42-+2H2O;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生证明含有铁,充分反应后过滤,得到黄色滤液,说明含有氧化铁,所以盐酸溶解后得到溶液中含有阳离子为:Fe3+、Fe2+;
故答案为:Fe3+、Fe2+;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,则
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) v×10-3L×n mol/L
n=6vn×10-3mol
样品中铁元素质量分数=$\frac{6vn×10{\;}^{-3}mol×56g/mol}{mg}$×100%=$\frac{0.336}{m}$Vn×100%=$\frac{33.6vn}{m}$,
故答案为:$\frac{33.6vn}{m}$.
点评 本题考查了物质组成的分析判断,主要是实验工厂分析,反应实质的理解应用,物质性质和反应定量计算的应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C消耗的速率与A消耗的速率相等 | |
| B. | 单位时间内生成a mol B,同时消耗a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
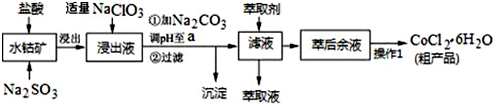
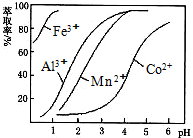
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
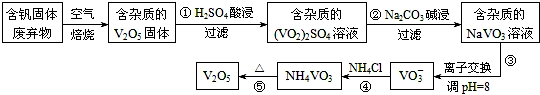
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
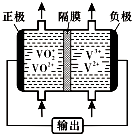
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
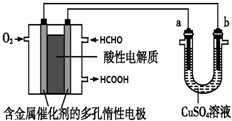
| A. | 当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑ | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4 OH- | |
| C. | 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- | |
| D. | 燃料电池工作时,负极反应为:HCHO+H2O-2e-═HCOOH+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
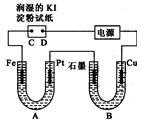 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com