
| X | ||
| Y | Z | W |
| T |
| A. | X、Z、W元素的原子半径以及它们的气态氢化物的热稳定性均依次递增 | |
| B. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| C. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 | |
| D. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
分析 X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍,且W和X为同一主族元素,设X的原子序数是a、W的原子序数为(a+8),2a=a+8,所以a=8,则X是O元素、W是S元素,Y、Z分别是Si、P、T为Sn元素,
A.元素的非金属性越强,其气态氢化物的稳定性越强;
B.SiO2是原子晶体、液态SO3是分子晶体;
C.Sn2O3具有氧化性和还原性,As的化合价为+3;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外).
解答 解:X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍,且W和X为同一主族元素,设X的原子序数是a、W的原子序数为(a+8),2a=a+8,所以a=8,则X是O元素、W是S元素,Y、Z分别是Si、P、T为Sn元素,
A.元素的非金属性越强,其气态氢化物越稳定,由于非金属性O>S>P,故H2O>H2S>H3P,故A错误;
B.SiO2是原子晶体、液态SO3是分子晶体,二氧化硅熔融时破坏的是化学键,三氧化硫气化时破坏的是分子间作用力,故B错误;
C.Sn2O3具有氧化性和还原性,As的化合价为+3,处于中间价,故既有氧化性也有还原性,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),Si是亲氧元素,在自然界中不能以游离态存在,故D错误;
故选C.
点评 本题考查元素周期律和元素周期表综合应用,为高频考点,明确元素周期表结构、同一周期同一主族元素性质递变规律是解本题关键,注意O、F元素没有最高价氧化物的水化物,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Al3+ | C. | Na+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
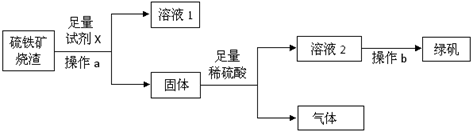
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氯 | 溴 | 碘 | |
(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
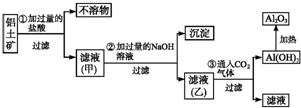 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生无色无味且能使石灰水变浑浊的气体,该溶液一定含有CO32- | |
| B. | 用洁净的铂丝蘸取少量某溶液在无色火焰上灼烧,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中加入BaCl2溶液,有沉淀生成,再加入稀盐酸,沉淀不消失,该溶液一定含有SO42- | |
| D. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
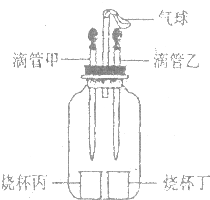 如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )| 选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
| A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠 |
| B | 盐酸 | 镁 | 盐酸 | 碳酸纳 |
| C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
| D | 水 | 氧化钙 | 盐酸 | 镁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取80.0g晶体用于配制溶液 | |
| B. | 将正确称取的晶体置于预先量取的500mL水中 | |
| C. | 定容前先将烧杯中溶解得到的溶液小心地直接倾倒至500mL规格的容量瓶 | |
| D. | 正确定容后,再将容量瓶塞盖好,反复上下颠倒,摇匀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com