
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
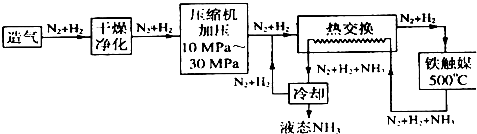
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下:
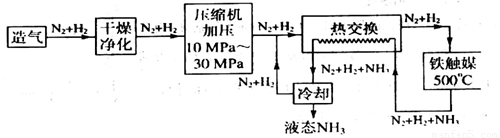
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
(8分)(1)Ca(H2PO4)2·H2O或Ca(H2PO4)2(1分)
(2)2NH3+CO2
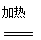 H2NCOONH4(1分)、H2NCOONH4=H2NCONH2+H2O(1分)
H2NCOONH4(1分)、H2NCOONH4=H2NCONH2+H2O(1分)
(3)53.1%(2分)
(4)从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;此温度下催化剂的活性最高
【解析】
试题分析:(1)普钙的有效成分是磷酸二氢钙,其化学式为Ca(H2PO4)2·H2O或Ca(H2PO4)2。
(2)氨气和二氧化碳在加压、加热条件下反应生成氨基甲酸铵,氨基甲酸铵脱水生成尿素和水,根据原子守恒可知,有关反应的化学方程式为2NH3+CO2 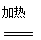 H2NCOONH4、H2NCOONH4=H2NCONH2+H2O。
H2NCOONH4、H2NCOONH4=H2NCONH2+H2O。
(3)根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸的物质的量=1mol×96%×92%=0.8832mol。由HNO3+NH3═NH4NO3可知,该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数=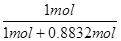 ×100%=53.1%。
×100%=53.1%。
(4)从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;由于在500℃时催化剂的活性最高,所以合成氨的反应需在500℃进行。
考点:考查普钙成分、尿素的制备;硝酸铵制备的有关计算、循环操作的意义以及反应条件的选择等


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三下学期5月针对训练理综化学试卷(解析版) 题型:填空题
随着世界粮食需求量的增加,农业对化学肥料的需求越越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下:

(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在
中进行合成氨。则沿X方向回去的物质是 。
(2)在侯氏制碱法中,从沉淀池中得到的母液要通人氨气、降温并加入 (填化学式),目的是 。
(3)沉淀池中的化学方程式是 。
(4)工业上将氨催化氧化可制硝酸。在硝酸生产中,催化剂铂网在氨的催化氧化反应中起的作 用是 。硝酸工业尾气对环境污染严重,若在催化剂存在下用甲烷将其中的一氧化氮还原为对空气无污染的物质,其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com