
氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化.
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol.
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(C)=0.4mol·L-1,则该反应的反应式是
A.X2+2Y2  XY2 B.2X2+Y2
XY2 B.2X2+Y2  2X2Y
2X2Y
C.3X2+Y2  2X3Y D.X2+3Y2
2X3Y D.X2+3Y2  2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:选择题
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入 a mol及b mol碘化氢(a>b),待反应2HI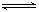 I2 (g)+H2(g) 达平衡后,下列说法肯定正确的是
I2 (g)+H2(g) 达平衡后,下列说法肯定正确的是
A.从反应开始到建立平衡所需时间:tA<tB
B.平衡时I2的浓度:c?I2?A = c?I2?B
C.平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器
D.平衡时HI的分解率:αA = αB
查看答案和解析>>
科目:高中化学 来源:2016届江西省高安市高三上学期第二次段考化学试卷(解析版) 题型:选择题
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:实验题
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO假设二: 假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
取少量黑色固体, |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如右图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解得到的固体产物的化学式为: 。

查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:填空题
过渡金属元素铁能形成多种配合物,如:Fe(CO)x等。
1.①基态Fe3+的M层电子排布式为 .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
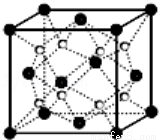
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm.(用含ρ、NA的计算式表示)
3.下列说法正确的是
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:选择题
现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的方法是
物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.萃取法 B.过滤法 C.分液法 D.蒸馏法
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
B | CaCO | CaCl2溶液中通入CO2产生白色沉淀 |
C | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
D | Zn具有还原性和导电性 | 可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g,下列判断正确的是
A.原溶液中投入铁粉物质的量是0.25mol
B.原溶液中的HNO3浓度是2.0mol/L
C.反应后的溶液中还可以溶解9.6g铜
D.反应后的溶液中c(Fe2+):c(Fe3+)=1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com