
| A、在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| B、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| C、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
| D、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、燃料电池是将燃料燃烧产生的热能直接转变为电能 |
| B、铅蓄电池在放电时,正极发生的反应是 Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| C、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
| D、钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ |
| B、碳酸氢钠溶液与稀盐酸混合:CO32-+2H+═H2O+CO2↑ |
| C、硫酸铜溶液与氢氧化钡混合:Cu2++2OH-═Cu(OH)2↓ |
| D、稀盐酸滴在石灰石上:CaCO3+2H+═H2O+CO2↑+Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H3O++CO32- |
| B、NH4++OH-?NH3?H2O |
| C、HSO3-+H2O?H2SO3+OH- |
| D、H2O+H2O?H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
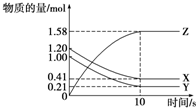 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、反应开始到10 s,用Z表示的平均反应速率为0.158 mol?L-1?s-1 |
| B、反应开始到10 s,X的物质的量浓度减少了0.79 mol?L-1 |
| C、反应开始到10 s,Y的物质的量浓度减少了0.395 mol?L-1 |
| D、反应的化学方程式为X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.表是4种指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.表是4种指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 36.02 | 35.32 | 35.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 |
| C、往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com