
| A、12C和14C |
| B、NO和NO2 |
C、CH3CH2CH2CH3和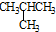 |
| D、CH3COOH和CH3OCH3 |
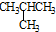 具有相同的分子式、不同的结构,二者互为同分异构体,故C正确;
具有相同的分子式、不同的结构,二者互为同分异构体,故C正确;

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
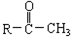 与NaOH溶液、碘水三者混合后可发生下列反应:?
与NaOH溶液、碘水三者混合后可发生下列反应:? ?
?
| A、HCHO |
| B、CH3CH2COCH2CH3 |
| C、CH3CHO |
| D、CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6:3:2 |
| B、3:1:1 |
| C、1:2:3 |
| D、1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、NaHCO3溶液与盐酸反应:H++HCO3-═H2O+CO2↑ |
| C、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| D、Fe2+和Cl2的反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 释氢 |
| A、储氢过程中,NaHCO3被氧化 |
| B、释氢过程中,每消耗0.1mol H2O可放出2.24L的H2 |
| C、储氢、释氢过程均无能量变化 |
| D、NaHCO3、HCOONa均含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液:CH3COO-、NO3-、SO42-、I- |
| B、c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |
| C、酸性环境下:Na+、Cu2+、NO3-、SO42- |
| D、pH=7的溶液中:K+、Na+、Fe3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单氢化物的热稳定性:Y>X |
| B、简单离子的半径:Z>X>Y |
| C、Z的最高价氧化物对应水化物既能与强酸反应又能与强碱反应生产盐和水 |
| D、由Y、W、Q三种元素形成的某种化合物,可用于检查司机酒后驾车 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com