
| A、硅胶多孔,吸附水份能力强,所以常用作袋装食品的干燥剂 | B、“煤制油”是不可能实现的,“煤制油”属于伪科学 | C、烟气脱硫是防治酸雨的一种有效措施 | D、天然气属于高效清洁燃料 |


科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:填空题
(16分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)

请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色
C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到Fe2O3固体
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是
A.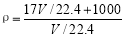 B.
B.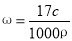
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:选择题
向含有NaBr 、KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干并灼烧,最后剩余的固体物质是
A.NaCl 和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:选择题
“纳米技术是当今科学研究的前沿之一,l纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是
A.所得分散系不稳定 B.一定能形成溶液
C.不能透过滤纸 D.有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:填空题
(4分)有下列物质:①空气 ②O2 ③NaHSO4 ④氨水 ⑤CuSO4·5H2O ⑥NaOH ⑦CO2 ⑧Fe2O3 ⑨金刚石 ⑩H2SO4,请回答下列问题(请在横线上填写序号):
(1)属于混合物的有 ;
(2)属于酸性氧化物的有 ;
(3)属于碱的有 ;
(4)属于盐的有 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
区别溶液和胶体最简单的方法是
A、丁达尔现象 B、闻气味
C、过滤 D、根据分散质微粒直径
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
水滑石(MgaAlb(OH)c(CO3)d·xH2O)用作阻燃剂及催化剂的载体
(1)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为 。
(2)为确定水滑石的组成,进行如下实验:取水滑石样品60.2g进行加热时,温度与剩余固体质量的关系如图。认真分析图中曲线变化情况回答下列问题(已知样品在400℃时已完全失水)
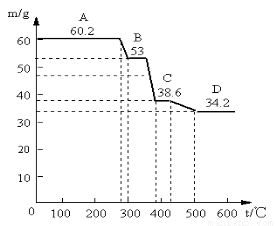
①当温度在0~280℃质量不变,是什么原因: 。C→D减少的物质其物质的量为
②该水滑石的化学式为 (写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
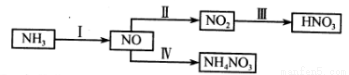
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。

①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
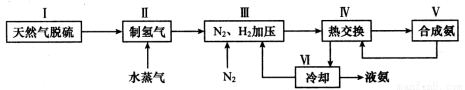
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206.4 kJ/mol
CO(g)+3H2(g) △H = +206.4 kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2 kJ/mol
CO2(g)+H2(g) △H = —41.2 kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com