
���Ӽ��ܵ����������ڰ뵼�幤ҵ�͵����մɵ�������һ�ִ��Ⱥܸߵ�������乤ҵ��ȡ�������£�

��1��ʵ���ҹ������������������̨����Ȧ���ձ��� ��©����
��2������A�ijɷֳ�������Co3��PO4��3��Fe(OH)3��� ���ѧʽ��������CO3(PO4)2��Ŀ���� ��
��3��Co��ϡ���ᷴӦ���� Co2+�����ӷ���ʽΪ�� ��
��4������B��������ϴ�ӡ�����������գ������ط���ͼ���£�д�����л�ѧ��Ӧ����ʽ��

��AB�� ��
��BC�� ��
��1����������2��Si ����pH����֤Co2+����������ʹ������ȫ������
��3��3Co+8H++2NO3-=3Co2++4H2O+2NO��
��4��CoC2O4 CoO+CO��+CO2�� 6CoO+O2
CoO+CO��+CO2�� 6CoO+O2 2Co3O4
2Co3O4
��������
�����������1��ʵ���ҹ������������������̨����Ȧ���ձ�����������©������2���ڼ��������ữʱ�ܡ�Fe�������ᷢ����Ӧ�õ������ܡ���������Si������ϡ���ᷢ����Ӧ�����Թ��˺����������A�С��������A����Ҫ�ɷֳ�������Co3��PO4��3��Fe(OH)3���Si������CO3(PO4)2��Ŀ���ǵ���pH����֤Co2+����������ʹ������ȫ����������3��Co��ϡ���ᷴӦ���� Co2+�����������غ㶨�ɺ͵����غ㡢����غ㣬��֪�÷�Ӧ�����ӷ���ʽΪ3Co+8H++2NO3-=3Co2++4H2O+2NO������4������B(CoC2O4)���շ����ֽⷴӦ��CoC2O4 =CoO+CO��+CO2�����õ�����ΪCoO��n(CoC2O4)=14��7g��147g/mol=0��1mol;����Ԫ���غ�ɵ�m(CoO)=0��1mol��75g/mol=7��5g;����t3ʱ���������Ϊ8��03g�����������غ㶨�ɿ�֪��BC�η����˷�Ӧ��6CoO+O2
=CoO+CO��+CO2�����õ�����ΪCoO��n(CoC2O4)=14��7g��147g/mol=0��1mol;����Ԫ���غ�ɵ�m(CoO)=0��1mol��75g/mol=7��5g;����t3ʱ���������Ϊ8��03g�����������غ㶨�ɿ�֪��BC�η����˷�Ӧ��6CoO+O2 2Co3O4��
2Co3O4��
���㣺��������ķ��뷽�����Լ���ʹ�á���ѧ����ʽ���ӷ���ʽ����д���йؼ����֪ʶ��


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и�����ѧ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
W��X��Y��Z���ֶ�����Ԫ����Ԫ�����ڱ��е����λ����ͼ��ʾ��W����̬�⻯���������ۺ����ᷴӦ�������ӻ�������н�����ȷ����
W | X |
|
| Y | Z |
A��X��Y��Z������⻯���ȶ�����������Z
B��ZԪ���������Ӧˮ���������һ��ǿ��Y
C��ZԪ�ص����ڻ�ѧ��Ӧ��ֻ����������
D��X��Y��ZԪ���γɵĵ��������ӻ�ԭ����ǿ����Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ӱ�ʡ��ɽ�и���4�µڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�������Լױ�Ϊ��Ҫԭ�ϣ���������·�ߺϳɻ�ױƷ��ù�����ԡ��ǻ�������������


��ش�
��1���л���C7H7Br������Ϊ ��
��2����Ʒ��Ħ������Ϊ ��
��3���ڢ١��ķ�Ӧ������ȡ����Ӧ���� ��
��4�� ��һ�������·����ۺϷ�Ӧ���ɸ߷��ӻ����д���÷�Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ�� ��
��һ�������·����ۺϷ�Ӧ���ɸ߷��ӻ����д���÷�Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ�� ��
��5�� ��ͬ���칹��ܶ࣬���з������������� �֡�
��ͬ���칹��ܶ࣬���з������������� �֡�
������FeCl3��Һ������ɫ�����ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ�����ޣ�CH3�ṹ������ͬ���칹���к˴Ź���������ʾ����5�ַ�Ľṹ��ʽΪ ��
��6���߷��ӻ����� ��һ�ֽ������ϣ��������кϳ�·����Ϣ���Լױ�Ϊԭ�Ϻϳɸø߷��ӻ��������ƺϳ�·��(���Լ����ܼ���ѡ)��ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
��һ�ֽ������ϣ��������кϳ�·����Ϣ���Լױ�Ϊԭ�Ϻϳɸø߷��ӻ��������ƺϳ�·��(���Լ����ܼ���ѡ)��ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��

��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�������и�����һ��ģ�⿼�Ծ����ۻ�ѧ�Ծ��������棩 ���ͣ������
ij�жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5��ֱ��С�ڵ���2.5 �����������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣
�����������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣
��ش��������⣺
��1����PM2.5����������ˮ�����Ƴɴ���������
����ø������������ӵĻ�ѧ��ּ���Ũ�����±���
���� | H+ | K+ | Na+ | NH4+ | SO42�� | NO3�� | Cl�� |
Ũ��/mol��L��1 | δ�ⶨ | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
���ݱ��������ж�������pH= ��
��2��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�
��֪��H2��g��+1/2O2��g��=H2O��g�� ��H=��241.8kJ��mol��1
C��s��+1/2O2��g��=CO ��g�� ��H=��110.5kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ�� ���� ��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ����� ��
A��Ca(OH) 2 B��Na2CO3 C��CaCl2D��NaHSO3
��3������β������NOx��CO�����ɼ�ת��
�� ��1mol������0.8molN2��0.2molO2�������еĻ�ѧ��ӦʽΪN2 (g)+O2(g) 2NO(g) ��H
2NO(g) ��H 0
0
1300��ʱ��1mol���������ܱ������ڷ�Ӧ�ﵽƽ�⣬���NOΪ8��10��4mol��������¶��µ�ƽ�ⳣ��K= ��
���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ����ԭ���� ��
��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NOx����Ⱦ���仯ѧ��Ӧ����ʽΪ ���������������������������������������� ��
�� ����ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO��g��= 2C��s��+O2��g��
��֪�÷�Ӧ�ġ�H 0���жϸ������ܷ�ʵ�ֲ����������ݣ� ��
0���жϸ������ܷ�ʵ�ֲ����������ݣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�������и�����һ��ģ�⿼�Ծ����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ����
A��1 L 1 mol��L-1��NaClO ��Һ�к���ClO������ĿΪNA
B��pH��1�Ĵ�����Һ�У�CH3COO����OH����Ŀ֮��Ϊ0.1NA
C��78 g ���к���̼̼˫������ĿΪ3NA
D����״���£�6.72 L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�ϲ��и���3�µ�һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ҹ�������Ա�Դ�ͳ��ҩΪԭ�����Ƶû�����I����ת��Ϊ���п����־����ԵĻ�������й�ת����ͼ��ʾ�������й�˵������ȷ����
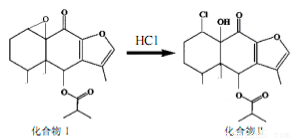
A��������I����ʽΪC19H24O5
B��������I �͢����������KMnO4��Һ��NaOH��Һ��Ӧ
C���������һ���������ܷ���ȡ������ȥ���ӳɷ�Ӧ
D�����黯��������Ƿ�����I����Br2��CCl4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ������У���ϵ��в��ԣ�һ����ѧ�Ծ��������棩 ���ͣ������
���ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�����������ں��Ӹֹ죬���һ���������ұ�����۵�Ľ����緰�������̵ȡ�



��1��ijУ��ѧ��ȤС��ͬѧ��ȡ�������������̲��е�ʵ��װ�ã���ͼ�ף��������ȷ�Ӧ�������׳�ۡ�ȡ��Ӧ��ġ����顱�������ᣬ�����еμ�KSCN��Һ��������Һ��Ѫ��ɫ���������������ԭ���˿��ܻ���û��Ӧ��Ĵ����������⣬����һ��ԭ���ǡ� ����
��2����֤���������á����顱�к��н���������ѡ�� �������Լ����ƣ�����������Ӧ�����ӷ���ʽΪ�� ����
��3��Ϊ�˷�ͼ��ȱ�ݸ���ͼ��װ�ý������ȷ�Ӧ��ȡ��Ӧ��ġ����顱�������ᣬ�����еμ�KSCN��Һ����Һû�г���Ѫ��ɫ��Ϊ�ⶨ��ʵ������ �����顱�ijɷ֣�ʵ��������ͼ��ʾ��

�����������↑ʼ��������ȫ������pH���±���ʾ��
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
��ʼ����ʱ��pH | 7.5 | 2.8 | 4.2 | 9.6 |
������ȫʱ��pH | 9.0 | 4.0 | 5 | 11 |
�� �Լ�AӦѡ�� �����Լ�BӦѡ�� ����������ţ�
A��ϡ���� B�������� C��H2O2��Һ D����ˮ E��MgCO3����
�� ��֪������Fe(OH)3��Ksp��1.1��10��36����Ӧ�����Һ��c(Fe3+)���� ��mol��L��1��
�� ������ȫ�ı�־�ǡ� ����
�� �����պ�ɫ��δM������Ϊ12.0 g����á����顱�Ĵ����ǡ� ������������ù��˹���ֱ��ϴ�ӡ���ɡ����������㡰���顱�Ĵ��ȣ���������ᡡ �����ƫ��ƫС������Ӱ�족����ԭ���ǡ� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ������У���ϵ��в��ԣ�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ��������Ʊ�����ȷ����
A��������ĵ��뷽��ʽ��H2SO3 2H+��SO32-
2H+��SO32-
B����Ȳ�ķ��ӽṹģ��ʾ��ͼ��
C��H2O2�ĵ���ʽ��
D�� ������3-��-1-����
������3-��-1-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�Ͼ��С��γ��и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ����������
A�������̪�Ժ�ɫ����Һ��Na+��Mg2+��NO3����HSO3��
B��0.1 mol��L��1 Fe(NO3)2��Һ��H+��Al3+��SO42����Cl��
C��0.1 mol��L��1��ˮ��Һ��K+��Na+��NO3����AlO2��
D����ˮ�������c(H+)=10��11mol��L��1����Һ��Ca2+��NH4+��Cl����HCO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com