
| A.SiO2具有较好的导电性,可用于制造半导体材料 |
| B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
科目:高中化学 来源:不详 题型:单选题
| A.①④⑤ | B.①②④⑤ | C.②③④⑥ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2 NaAlO2+3Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③⑤ |
| B.①③④ |
| C.④ |
| D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
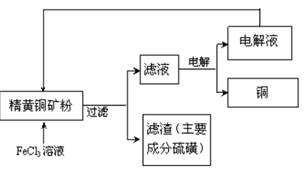
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝热反应是炼铁最常用的方法 |
| B.高纯度的硅单质用于制作光导纤维 |
| C.二氧化氯具有强化性,可用于自来水的杀菌消毒 |
| D.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com