
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:
其中第①步存在平衡:
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为 。在溶液中存在以下沉淀溶解平衡:常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
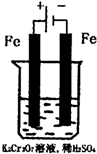
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO2- 4 |
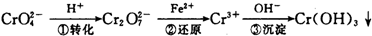
2- 4 |
2- 7 |
2- 3 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 | B、普通玻璃的主要成分是SiO2 | C、陶瓷的主要原料是黏土 | D、硅酸盐水泥以石灰石和黏土为主要原料 |
查看答案和解析>>
科目:高中化学 来源:2012届河南省洛阳市高三“一练”考试化学试卷 题型:填空题
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为: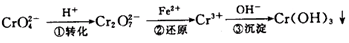
其中第①步存在平衡:
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为 。在溶液中存在以下沉淀溶解平衡: 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省洛阳市高三“一练”考试化学试卷 题型:填空题
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:

其中第①步存在平衡:

(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态[来源:Zxxk.Com]
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为
。在溶液中存在以下沉淀溶解平衡: 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com