
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
科目:高中化学 来源: 题型:选择题
| A. | 容器内只含有18O2、SO2、SO3三种分子 | |
| B. | 18O只存在18O2分子中 | |
| C. | 容器内含有18O2、S18O2、S18O3等分子 | |
| D. | 反应达到限度时,容器内只含有18O2、S18O2、S18O3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
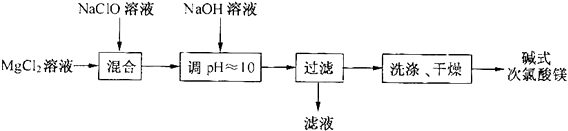
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
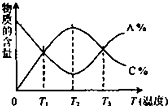 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 升高温度,平衡会向正反应方向移动 | |
| C. | 该反应的逆反应是放热反应 | |
| D. | 该反应在T2温度时达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Br2+6KOH═5KBr+KBrO3+3H2O | |
| B. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑ | |
| C. | 2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2KNO2+O2↑ | |
| D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$ N2O↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com