
| A. | 液态氧、烧碱、碘酒 | B. | 白磷、生石灰、熟石灰 | ||
| C. | 铁、干冰、氯化氢 | D. | 氮气、空气、胆矾 |
分析 解答本题需掌握单质、化合物及混合物的概念:
单质是由同种元素组成的纯净物;
化合物是由不同种元素组成的纯净物;
混合物是由多种物质组成的物质.
解答 解:A、液态氧是一种元素组成的纯净物,即是单质,烧碱是由三种元素组成的纯净物,故是化合物,碘酒是多种物质组成的溶液,故是混合物;故A正确.
B、白磷是单质,生石灰是一个为化合物,熟石灰是氢氧化钙的俗称属于化合物,故B错误.
C、铁是一种元素组成的纯净物,即是单质,干冰是由两种元素组成的纯净物,故是化合物,氯化氢是一种物质组成属于纯净物;故C错误;
D、氮气是一种元素组成的纯净物为单质,空气是多种物质组成的为混合物,胆矾是硫酸铜晶体属于化合物,故D错误.
故选A.
点评 本题考查了物质分类、物质组成、物质名称等知识点,要掌握物质的分类方法方面的内容,只有这样才能对各种物质进行正确的分类,题目较简单.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应达到平衡状态 | |
| B. | 该反应正在向左方向进行 | |
| C. | 达平衡状态时,H2的转化率应为96.3% | |
| D. | 增大H2的量,该反应平衡常数将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 元素周期律的实质是元素化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
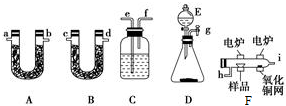
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
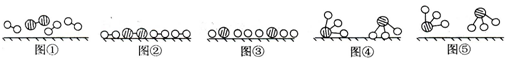
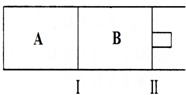
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com