
| A. | 石墨与金刚石 | B. | 1735Cl和1737Cl | C. | CO和CO2 | D. | 1H2、2D2和3T2 |
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
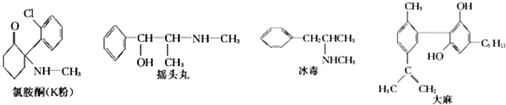
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )| A. | 6:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

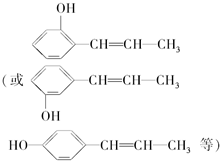 .
.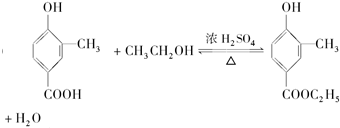 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com