
| ||
| ||


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
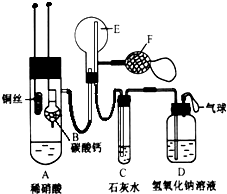 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.查看答案和解析>>
科目:高中化学 来源: 题型:
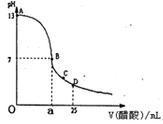
| A、c(H+)=c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、a=12.5 |
| D、a>12.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.21mol |
| B、0.24mol |
| C、0.19mol |
| D、0.14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的百分含量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com