
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1 mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是( )
A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物
B.Y和其他四种元素均可形成至少两种的二元化合物
C.RY2能与Y、Z形成的一种化合物反应生成Y2
D.Y、Z、W三种元素组成化合物的水溶液一定显碱性
科目:高中化学 来源: 题型:
某蓄电池的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是________(填下列字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是____________________。
A.NiO2 B.Fe
C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体镶嵌Zn块,或与该蓄电池的______极(填“正”或“负”)相连。
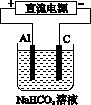
图K197
(3)以该蓄电池作电源,用如图K197所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)________________________________________________________________________
________________________________________________________________________。
(4)精炼铜时,粗铜应与直流电源的______极(填“正”或“负”)相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:



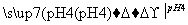

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是________________________________________________________________________。
乙同学认为应将方案中的pH调节到8,你认为此观点____________(填“正确”或“不正确”),理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2- X+ B.X+ Y3+
C.Y3+ Z2- D.X+ Z2-
| R | |||
| T | Q | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.氢化物的稳定性:X>Y>Z
D.四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )21世纪教育网版权所有
A.上述四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的认识正确的是
A.淀粉、蛋白质、油脂都属于天然高分子化合物.
B.C4 H10有3种同分异构体
C.乙烯使溴的四氯化碳溶液褪色是因为发生了取代反应
D.新制氢氧化铜可以鉴别乙酸、葡萄糖、乙醛和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
亮菌甲素为利胆解痉药适用于急性胆囊炎治疗等,其结构简式如右图所示
 下列有关叙述正确的是
下列有关叙述正确的是
A.亮菌甲素分子式为C12H11O5
B.亮菌甲素能与三氯化铁溶液发生显色反应,1mol最多能与5molH2发生加成反应
C.1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2mol NaOH
D.每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
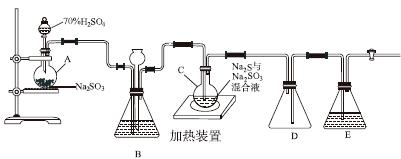
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O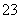 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com