
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
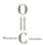 .根据上述信息,回答下列问题:
.根据上述信息,回答下列问题: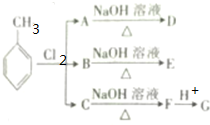
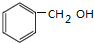 .
.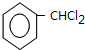 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$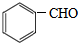 +2NaCl+H2O.
+2NaCl+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-N+3)mol | B. | $\frac{n}{A+106.5}$(A-N+51)mol | ||
| C. | $\frac{n}{A+35.5}$(A-N+51)mol | D. | $\frac{n}{A+106.5}$(A-N+47)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mL,NO | B. | 2.4mL,O2 | C. | 3.5mL O2 | D. | 4mL,NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
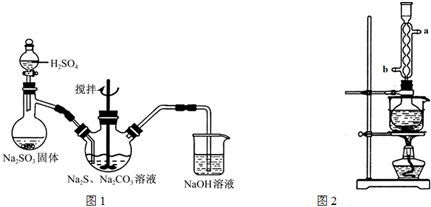
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
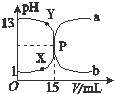 如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )
如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )| A. | 盐酸的物质的量浓度为1 mol•L-1 | |
| B. | P点时反应恰好完成,溶液呈中性,但它不是滴定终点 | |
| C. | X点时c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| D. | Y点时溶液呈碱性,溶液中c(H+)•c(OH-)>1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1mol/L的硫酸钠溶液中,所含Na+数为2NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe和足量盐酸完全反应失去的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com