
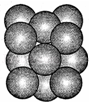
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:分析 (1)NH4+中N原子价层电子对数为4+$\frac{5-1-1×4}{2}$=4,则杂化轨道数目为4,SO42-中S原子孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=4,杂化轨道数目为4;
(2)基态钙原子的核外电子排布式为1s22s22p63s22p64s2;
(3)、FeO的晶体类型均与氯化钠晶体相同,均属于离子晶体,熔点 NiO>FeO,则晶格能NiO>FeO,阴离子相同,且阴、阳离子所带电荷数相同,离子半径越小,晶格能越大;
(4)由堆积方式可知为ABCABCABC型堆积方式,为面心立方密堆积,配位数为12,根据均摊法计算晶胞中原子数目,表示出晶胞质量,处于晶胞面对角线上的原子相邻,原子半径为r pm,则晶胞棱长为4r pm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r pm,再根据ρ=$\frac{m}{V}$计算.
解答 解:(1)NH4+中N原子价层电子对数为4+$\frac{5-1-1×4}{2}$=4,则杂化轨道数目为4,SO42-中S原子孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=4,杂化轨道数目为4,所以N、S原子杂化方式都是sp3杂化,SO42-中S原子价层电子对个数是4,没有孤电子对,则应为正四面体结构,
故答案为:sp3、sp3;正四面体;
(2)基态钙原子的核外电子排布式为1s22s22p63s22p64s2,M层排满应该是18个电子,N层排满应该是32个电子,所以没有排满的电子层为M能层和N能层;,
故答案为:M能层和N能层;
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,熔点 NiO>FeO,则晶格能NiO>FeO,阴离子相同,且阴、阳离子所带电荷数相同,离子半径越小,晶格能越大,所以r(Ni2+)<r(Fe2+),
故答案为:r(Ni2+)<r(Fe2+);NiO、FeO都是离子晶体,熔点NiO>FeO,NiO的晶格能较大,阴离子相同,且阴、阳离子所带电荷数相同,所以r(Ni2+)<r(Fe2+);
(4)由堆积方式可知为ABCABCABC型堆积方式,为面心立方密堆积,配位数为12,
晶胞中原子数为$\frac{1}{2}$×6+$\frac{1}{8}$×8=4,晶胞的质量为m=$\frac{4M}{{N}_{A}}$g,原子半径为r pm,则晶胞棱长为4r pm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r pm,则晶胞密度ρ=$\frac{4M}{{N}_{A}}$g÷(2$\sqrt{2}$r×10-10cm)3=$\frac{4M}{{N}_{A}×(2\sqrt{2}r×1{0}^{-10})^{3}}$g/cm3,
故答案为:12;$\frac{4M}{{N}_{A}×(2\sqrt{2}r×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型的判断、晶体类型与性质晶胞的计算等,需要学生具有一定的空间想象与数学计算能力,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 四种气态氢化物按稳定性:SiH4<CH4<H2O<HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCl | B. | CH3C(CH3)2I | C. | (CH3)3COOCCH2CH3 | D. | CH3C(CH3)2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
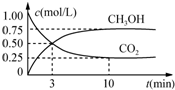 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率小于75% | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 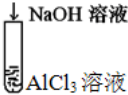 | 溶液由先浑浊后澄清 | Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O |
| C | 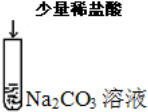 | 溶液中无气泡产生 | CO22-+H+=HCO3-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 | |
| C. | 某元素基态原子的电子排布图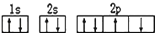 | |
| D. | Ca2+离子基态电子排布式为1s22s22p63s23p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com