
| A、HA |
| B、H+ |
| C、A- |
| D、OH- |
科目:高中化学 来源: 题型:
| A、CaCO3+2HCl=CaCl2+CO2↑+H2O | ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、CaCO3
| ||||
| D、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu和浓硫酸在加热条件下的反应:Cu+2H2SO4(浓)
| ||||
| B、含氟牙膏防治龋齿的化学原理:Ca5(PO4)3OH+F-?Ca5(PO4)3F+OH- | ||||
| C、用0.100mol?L-1的NaHSO4标准溶液滴定Ba(OH)2溶液,用酚酞做指示剂,接近滴定终点时的离子反应:H++OH-═H2O | ||||
| D、次磷酸(H3PO2)为一元中强酸,与NaOH溶液反应:H3PO2+OH-═H2PO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
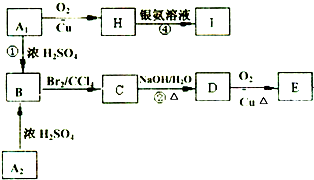 同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:
同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、Cl-、HCO3- |
| B、Na+、Fe3+、Cl-、HCO3- |
| C、Fe2+、Fe3+、Cl-、NO3- |
| D、Fe2+、Mg2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26g | B、36g |
| C、104g | D、130g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com