
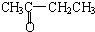 B.
B.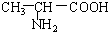 与
与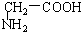
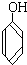 与
与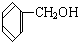 D.CH3CH2C≡CH与CH2=CH-CH=CH2
D.CH3CH2C≡CH与CH2=CH-CH=CH2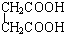 与
与  F.戊烯和环戊烷
F.戊烯和环戊烷分析 (1)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同;具有相同的分子式、不同结构的化合物互为同分异构体;
(2)常见的含氧官能团有:醛基、羰基、羧基、羟基等,根据有机物结构及官能团组成进行解答.
解答 解:(1)B.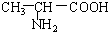 与
与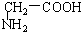 、E.
、E.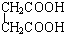 与
与  的结构相似,分子间相差若干个CH2原子团,它们分别互为同系物;
的结构相似,分子间相差若干个CH2原子团,它们分别互为同系物;
A.CH3CH2CH2CHO与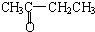 、D.CH3CH2C≡CH与CH2=CH-CH=CH2、F.戊烯和环戊烷的分子式相同,结构不同,二者互为同分异构体,
、D.CH3CH2C≡CH与CH2=CH-CH=CH2、F.戊烯和环戊烷的分子式相同,结构不同,二者互为同分异构体,
故答案为:BE;ADF;
(2)A中含氧官能团为醛基和羰基、B和E中含氧官能团为羧基、C中含氧官能团为羟基,
故答案为:醛基、羰基、羧基、羟基.
点评 本题考查了同系物、同分异构体的判断、有机物结构与含有官能团类型的关系,题目难度不大,注意掌握常见有机物结构与性质,明确同系物、同分异构体的概念及判断方法,能够根据有机物结构简式判断其含有的官能团类型.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 | B. | CH≡CH | C. | CH3C≡CH | D. | CH2═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
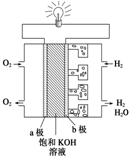 I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.
I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
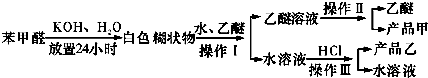
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式-COH | B. | 丙烷分子的比例模型为: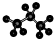 | ||
| C. | 四氯化碳分子的电子式为 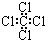 | D. | 2-乙基-1,3-丁二烯的键线式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
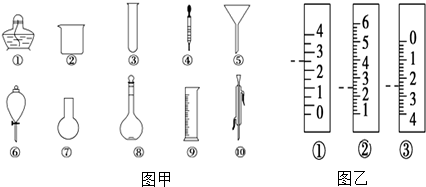
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com