
| A、此时,反应混合物总的物质的量为1mol |
| B、B的转化率为50% |
| C、A的平均反应速率为0.1mol?(L?min)-1 |
| D、a值为2 |
| △c |
| △t |
| △n |
| V?△t |
| 0.1mol |
| 0.5mol |
| △c |
| △t |
| △n |
| V?△t |
| 0.3mol |
| 0.4L×5min |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、加入等质量的铁粉,反应过程中放出H2的速率相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m<n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、①③⑤ |
| C、③④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C为非气态 |
| B、C为气态 |
| C、第二次达到平衡时C为气态 |
| D、第三次达到平衡时 C为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
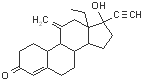
| A、依托孕烯的分子式为C21H28O2 |
| B、依托孕烯能与FeCl3溶液发生显色反应 |
| C、l mol依托孕烯最多能与5mol氢气发生加成反应 |
| D、依托孕烯能发生氧化、加成、消去、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 ml 0.5 mol/L MgCl2 溶液 |
| B、200 ml 0.25 mol/L HCl溶液 |
| C、200 ml 0.25 mol/L CaCl2溶液 |
| D、50 ml 1 mol/L NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com