解:W和Z组成化合物WZ
3溶液遇苯酚呈紫色,则W为Fe,Z为Cl;X、Y、Z属同一短周期,其离子以X
2+、Y
3+、Z
-的形式存在,则X为Mg,Y为Al;
(1)因氯元素的最高化合价为+7价,则对应的最高价氧化物对应水化物为HClO
4,其名称为高氯酸,故答案为:高氯酸;
(2)因镁与二氧化碳反应生成氧化镁和碳,反应为2Mg+CO
2
2MgO+C,故答案为:2Mg+CO
2
2MgO+C;
(3)铝与二氧化锰反应生成氧化铝和锰,其反应为3MnO
2+4Al

2Al
2O
3+3Mn,由电离平衡H
2O+AlO
2-+H
+?Al(OH)
3?Al
3++3OH
-,可知加强酸或强碱时都能使氢氧化铝溶解,
故答案为:3MnO
2+4Al

2Al
2O
3+3Mn;在氢氧化铝中存在电离平衡H
2O+AlO
2-+H
+?Al(OH)
3?Al
3++3OH
-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;
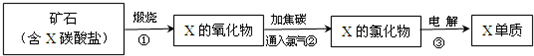
(4)28.0gFe的物质的量为
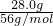
=0.5mol,由3Fe+4H
20

Fe
3O
4+4H
2,则氢气的物质的量为
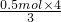
,其标况下的体积为

mol×22.4L/mol=14.9L,故答案为:14.9;
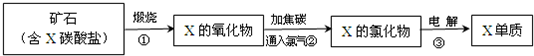
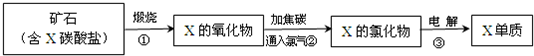
(5)由流程图中的反应②可知,氧化镁与碳和氯气反应生成氯化镁和碳的氧化物,lmolMgO参加反应时,有2mol电子转移且生成三种产物,即1mol氯气作氧化剂时,

mol碳作还原剂,
且生成均为
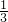
mol的CO
2和CO,其反应为3MgO+3Cl
2+2C=3MgCl
2+CO
2+CO,故答案为:3MgO+3Cl
2+2C=3MgCl
2+CO
2+CO;
(6)由Fe
2+在酶为催化剂的作用下转化为氧化物(可用Fe
2O
3表示),该反应中的另一种反应物二氧化碳转化为甲醛,其离子反应为CO
2+4Fe
2++5H
20

HCHO+2Fe
2O
3+8H
+,
故答案为:CO
2+4Fe
2++5H
20

HCHO+2Fe
2O
3+8H
+.
分析:W和Z组成化合物WZ
3溶液遇苯酚呈紫色,则W为Fe,Z为Cl;X、Y、Z属同一短周期,其离子以X
2+、Y
3+、Z
-的形式存在,则X为Mg,Y为Al;
(1)根据氯元素的最高化合价来分析对应的酸;
(2)镁与二氧化碳反应生成氧化镁和碳;
(3)由铝热反应原理来书写化学反应,利用电离平衡移动来解释氢氧化铝既可溶于强酸又可溶于强碱;
(4)由铁和水蒸气反应的方程式来计算;
(5)由步骤可知氧化镁与碳、氯气反应,利用电子的转移数目来分析产物,并书写反应方程式;
(6)由W
2+在酶为催化剂的作用下转化为氧化物(可用W
2O
3表示其中W);该反应中的另一种反应物二氧化碳转化为甲醛,来书写离子反应方程式.
点评:本题考查学生利用物质的检验及物质原子在周期表中的位置来推断元素,然后利用元素化合物知识结合习题中的信息来解答,明确信息的使用及挖掘是解答本题的关键.

 2MgO+C,故答案为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2 2MgO+C;
2MgO+C; 2Al2O3+3Mn,由电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,可知加强酸或强碱时都能使氢氧化铝溶解,
2Al2O3+3Mn,由电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,可知加强酸或强碱时都能使氢氧化铝溶解, 2Al2O3+3Mn;在氢氧化铝中存在电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;
2Al2O3+3Mn;在氢氧化铝中存在电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;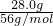 =0.5mol,由3Fe+4H20
=0.5mol,由3Fe+4H20 Fe3O4+4H2,则氢气的物质的量为
Fe3O4+4H2,则氢气的物质的量为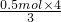 ,其标况下的体积为
,其标况下的体积为 mol×22.4L/mol=14.9L,故答案为:14.9;
mol×22.4L/mol=14.9L,故答案为:14.9; mol碳作还原剂,
mol碳作还原剂,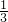 mol的CO2和CO,其反应为3MgO+3Cl2+2C=3MgCl2+CO2+CO,故答案为:3MgO+3Cl2+2C=3MgCl2+CO2+CO;
mol的CO2和CO,其反应为3MgO+3Cl2+2C=3MgCl2+CO2+CO,故答案为:3MgO+3Cl2+2C=3MgCl2+CO2+CO; HCHO+2Fe2O3+8H+,
HCHO+2Fe2O3+8H+, HCHO+2Fe2O3+8H+.
HCHO+2Fe2O3+8H+.