
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】为测定苏打中Na2CO3的含量(含NaHCO3杂质),实验小组设计了如下三个实验方案。
方案Ⅰ.①称量:仪器X的质量为ag;②称量:仪器X和装有试样的质量为bg;③加热;④冷却;⑤称量:仪器X和残余物的质量为cg;⑥重复____________操作,直至恒重,质量为dg。
(1)仪器X是____________(填名称),方案 Ⅰ 的实验原理是:____________(用化学方程式表示)。
(2)请将步骤⑥补充完整:重复____________操作,步骤⑥的目的是:____________。
(3)计算Na2CO3的质量分数要用到的数据是____________(选填a、b、c、d)。
方案Ⅱ.称量一定量样品,选用合适的装置测定样品与硫酸反应生成的气体体积。
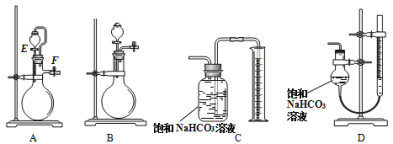
(4)为提高测定准确性,应选用发生装置____________(选填“A”或“B”)和量气装置D;装置D比装置C准确性高的原因是____________(任一条原因)。
(5)检查装置A的气密性:向A的分液漏斗中加入适量水,按图连接好装置,关闭止水夹F,打开活塞E,发现分液漏斗中的水持续滴下,说明A漏气。该判断是否正确,并说明理由:____________。
方案Ⅲ.称量0.2570g样品,置于锥形瓶中,加适量水溶解,滴2滴酚酞试液,用0.1000mol/L盐酸滴定至溶液由浅红色变成无色且半分钟不变色,反应原理:Na2CO3+HCl→NaHCO3+NaCl,重复上述操作两次。
(6)用密度为1.19g/mL、质量分数为0.37的浓盐酸,配制1L0.1000mol/L稀盐酸,所需的定量仪器是:滴定管、1L容量瓶,其中滴定管的作用是____________。滴定管和容量瓶在使用前都要进行的操作是__________。(选填序号)
Y.检漏 Z.用蒸馏水洗涤 W.用待装液润洗
(7)根据表中数据,碳酸钠的质量分数为____________(小数点后保留四位)。
滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 0.2570 | 1.00 | 21.01 |
2 | 0.2570 | 0.50 | 20.49 |
3 | 0.2570 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见下图。有关说法错误的是
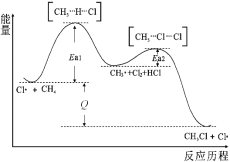
A.Cl·是由Cl2在光照下化学键断裂生成的,该过程可表示为:![]()
B.反应过程一定无CH3CH3的生成
C.图中的反应热Q>0,其大小与Ea1、Ea2无关
D.CH4转化为CH3Cl的过程,C-H键发生了断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把5.1g镁铝合金的粉末放入足量的氢氧化钠溶液中,得到2.24LH2(标准状况下测定)。
(1)合金中镁的质量为________。
(2)写出该合金溶于足量的氢氧化钠溶液的化学方程式:_________________________。
Ⅱ. 在AlCl3和MgCl2的混合溶液中逐滴加入氢氧化钠溶液,生成沉淀的物质的量与加入氢氧化钠的物质的量的关系如图所示。
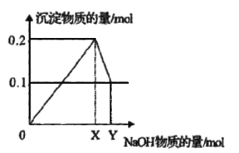
(3)在混合溶液中AlCl3和MgCl2的物质的量之比为_____________。
(4)写出XY段发生反应的离子方程式_____________________________。
(5)X=____________;Y=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是:
A.标准状况下,22.4 LCC14中所含C—Cl键的数目为4NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C.向密闭容器中充入1 mol N2O4,加热使之充分分解,生成 NO2的分子数为2NA
D.7.8g Na2O2中所含的阴离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 。水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
。水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
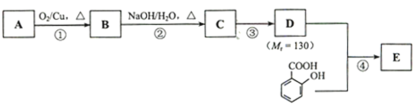
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为______;核磁共振氢谱分析显示,A的有五种不同化学环境的氢,且峰面积之比为3:2:2:2:1。A的名称为______。
(2)B能与银氨溶液发生反应,该反应的化学方程式为______。
(3)C有____种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:___。
(4)第③步的反应类型为______;D所含官能团的名称为_____。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式:______。
a.分子中有6个碳原子在一条直线上;
b.分子中所含官能团包括水杨酸具有的官能团;
(6)第④步的反应条件为______;写出E的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
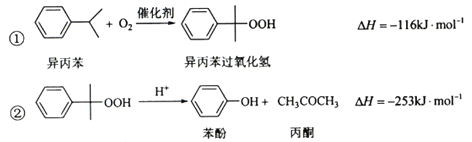
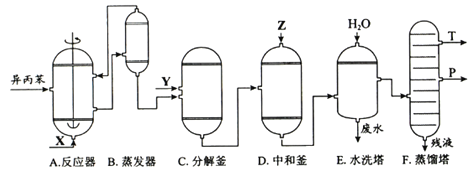
相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. NaOH b. CaCO c. NaHCO d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净的金属钠在干燥的空气中缓慢加热,被氧化后得到3.5 g固体,由此可判断出产物是( )
A.氧化钠B.过氧化钠
C.氧化钠和过氧化钠的混合物D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g) ![]() B(g)+2C(g)为放热反应,下列有关说法错误的是( )
B(g)+2C(g)为放热反应,下列有关说法错误的是( )
A. 该反应属于可逆反应B. A可以完全转化为B和C
C. 化学变化伴随能量变化D. 2molA比2molC的总能量高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com