
【题目】(1)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,该物质中存在的化学键有离子键、_______和_______;含有的Fe3+的核外电子样布式为_______________。
(2)KCN 可被H2O2 氧化为KOCN
①KOCN 可作为制药原料,其晶体类型是__________;碳原子采取sp杂化,1mol该物质中含有的π键数目为___________。含有的三种非金属元素的电负性由大到小的顺序是________。(2)H2O2常温下是液体,沸点较高(150℃),其主要原因是____________。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As 原子的杂化方式为____,雌黄和SnCl2 在盐酸中反应转化为雌黄(As4S4) 和SnCl4,SnCl4 分子的空间构型为_______。
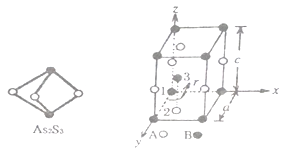
(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为______________,该晶胞参数分别为apm,cpm,γ=120°如图示;1号原子坐标为(0,0,0),2 号原子坐标为(1/3,2/3,0),则3号原子坐标为____________,计算上述晶体中A和B 两原子间的最小核间距为________pm。
【答案】共价键 配位键 [Ar]3d5 离子晶体 2NA O>N>C H2O2分子之间可以形成氢键 sp3杂化 正四面体形 AB (1/2,2/3,1/2) ![]()
【解析】
试题(1) [Fe(CN)6]4-中Fe2+与CN-是配位键,CN-中C与N之间是共价键;Fe3+核外有23个电子;(2)①KOCN是离子化合物;KOCN中C与N之间是叁键,叁键中一个是![]() 键,2个
键,2个![]() 键;同周期元素从左到右电负性增大;②H2O2分子间含有氢键;(3)As2S3中As原子是价电子对数是
键;同周期元素从左到右电负性增大;②H2O2分子间含有氢键;(3)As2S3中As原子是价电子对数是![]() ;(3)计算SnCl4分子中Sn原子价电子对数,判断SnCl4分子的空间构型;(4)根据均摊原则计算晶体的化学式;根据1号原子、2号原子坐标,可判断3号原子坐标值;根据图示,2号A原子与左下角的B原子核间距最小。
;(3)计算SnCl4分子中Sn原子价电子对数,判断SnCl4分子的空间构型;(4)根据均摊原则计算晶体的化学式;根据1号原子、2号原子坐标,可判断3号原子坐标值;根据图示,2号A原子与左下角的B原子核间距最小。
解析:(1) [Fe(CN)6]4-中Fe2+与CN-是配位键,CN-中C与N之间是共价键,所以Fe4[Fe(CN)6]3中存在的化学键有离子键、配位键和共价键; Fe3+核外有23个电子, Fe3+的核外电子样布式为[Ar]3d5;(2)①KOCN是离子化合物,晶体类型是离子晶体;KOCN中C与N之间是叁键,叁键中一个是![]() 键,2个
键,2个![]() 键,所以1mol该物质中含有的π键数目为2NA;同周期元素从左到右电负性增大,三种非金属元素的电负性由大到小的顺序是O>N>C;②H2O2分子间可以形成氢键,所以H2O2沸点较高;(3)As2S3中As原子是价电子对数是
键,所以1mol该物质中含有的π键数目为2NA;同周期元素从左到右电负性增大,三种非金属元素的电负性由大到小的顺序是O>N>C;②H2O2分子间可以形成氢键,所以H2O2沸点较高;(3)As2S3中As原子是价电子对数是![]() ,As原子的杂化方式为sp3杂化;(3)SnCl4分子中Sn原子价电子对数是
,As原子的杂化方式为sp3杂化;(3)SnCl4分子中Sn原子价电子对数是![]() ,无孤对电子,SnCl4分子的空间构型是正四面体形;(4)根据均摊原则,该晶胞含有B原子数
,无孤对电子,SnCl4分子的空间构型是正四面体形;(4)根据均摊原则,该晶胞含有B原子数![]() ,含有A原子数
,含有A原子数![]() ,A、B原子个数比是1:1,所以晶体的化学式AB;根据1号原子、2号原子坐标,可判断3号原子坐标值是(1/2,2/3,1/2);根据图示,2号A原子与左下角顶点的B原子核间距最小,根据原子坐标,可以发现底面的2号A原子起始位处正三角形重心,根据立体几何知识,根据余弦定理,cos120°=(a2+a2d2)/2aa,可得d=
,A、B原子个数比是1:1,所以晶体的化学式AB;根据1号原子、2号原子坐标,可判断3号原子坐标值是(1/2,2/3,1/2);根据图示,2号A原子与左下角顶点的B原子核间距最小,根据原子坐标,可以发现底面的2号A原子起始位处正三角形重心,根据立体几何知识,根据余弦定理,cos120°=(a2+a2d2)/2aa,可得d=![]() a,这是底面最长对角线的距离,A和B的距离为其1/3,即=
a,这是底面最长对角线的距离,A和B的距离为其1/3,即=![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA | 0 | ||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | B | ① | ② | Ne | |||||
3 | ③ | ④ | ⑤ | Si | ⑥ | ⑦ | |||
(1) ①的元素符号是__________
(2) ②和⑥两种元素的原子半径大小关系:_________(填“>”或“<”);
(3) ③和⑤两种元素的金属性强弱关系:________(填“>”或“<”);
(4)③和⑦形成的化合物属于_________(填“离子化合物”或“共价化合物”);写出该化合物的电子式为:______________________;
(5)写出元素②在周期表中的位置_______________________;
(6)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
①、  此键线式所表示有机物的结构简式是:________________;
此键线式所表示有机物的结构简式是:________________;
②、 此有机物的系统命名为:________________;
此有机物的系统命名为:________________;
③、 ![]() 此有机物用系统命名法的名称是:________________;
此有机物用系统命名法的名称是:________________;
④、写出结构简式: 2,2-二甲基-3-乙基己烷________________;
⑤、写出结构简式: 2-甲基-2-丁烯________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如下图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是

A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z点对应的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为LixC+Li1-xCoO2![]() C+LiCoO2,锂硫电池的总反应为2Li+S
C+LiCoO2,锂硫电池的总反应为2Li+S![]() Li2S。有关两种电池说法正确的是 ( )
Li2S。有关两种电池说法正确的是 ( )
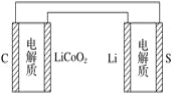
A. 锂离子电池放电时,Li+向负极迁移
B. 当锂硫电池充电时,硫电极发生氧化反应
C. 理论上两种电池的电极材料单位质量相同时释放的电能相同
D. 上图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1) 2-溴丙烷的消去反应(化学方程式)______________________________________;
(2) 1,2-二溴乙烷的水解(化学方程式)_______________________________________;’
(3)二氢香豆素( )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、_________________;
)需要用到的试剂有:NaOH溶液、_________________;
(4)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。则A的结构简式为______________________;A是否存在顺反异构体?________ (填“是”或者“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的的是
A. 乙烷(乙烯):通过酸性高锰酸钾溶液,洗气
B. 乙醇(水):加入新制生石灰,蒸馏
C. 溴苯(溴): 加入![]() 溶液,充分振荡静置后,分液
溶液,充分振荡静置后,分液
D. 乙酸(乙醇):加入金属钠,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
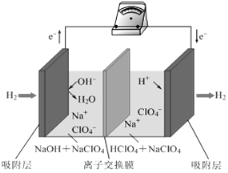
A. 放电时,两极电解质溶液的酸碱性均降低
B. 负极的电极反应是H2-2e-+2OH- ==== 2H2O
C. 电池的总反应是2H2+O2 ==== 2H2O
D. 电解质溶液中Na+向右移动,ClO![]() 向左移动
向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com