
| A. | 胡粉中的Pb显+4价 | |
| B. | 这里的“火”中含有炭 | |
| C. | 此过程中可能发生了化合反应 | |
| D. | 在元素周期表中铅与炭都位于第ⅥA族 |
分析 A、根据化合价代数和为0来分析;
B、根据金属铅要通过热还原法来冶炼来分析;
C、根据胡粉来冶炼铅的步骤是:胡粉先分解为PbO,然后C将PbO还原为Pb单质来分析;
D、铅和炭的最外层均有4个电子.
解答 解:A、由于碳酸根为-2价,而氢氧根为-1价,根据化合价代数和为0可知,胡粉中的Pb显+2价,故A错误;
B、金属铅要通过热还原法来冶炼,故在上述过程中中2PbCO3•Pb(OH)2先分解为氧化铅(PbO),然后被碳还原为铅(Pb),即“火”中含有炭,故B正确;
C、根据胡粉来冶炼铅的步骤是:胡粉先分解为PbO:2PbCO3•Pb(OH)2$\frac{\underline{\;△\;}}{\;}$3PbO+2CO2↑+H2O,然后C将PbO还原为Pb单质:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO↑,无化合反应,故C错误;
D、铅和炭的最外层均有4个电子,故均为第IVA族,故D错误.
故选B.
点评 本题考查了金属铅的冶炼的原理和方法,由于铅用热还原法来冶炼,故可推知用胡粉来冶炼铅所发生的反应,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在大理石上:2H++CO32-═CO2↑+H2O | |
| B. | 硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 向NaOH溶液中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 氢氧化钠与NaHCO3溶液反应:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液分层,上层几乎无色,下层紫红色 | |
| B. | 溶液分层,上层紫红色,上层几乎无色 | |
| C. | 溶液分层,上层几乎无色,下层橙红色 | |
| D. | 溶液呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在0.1mol•L-1 的NaHA溶液pH=4,则H2A为强酸 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA | |
| B. | 1 mol苯乙烯(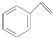 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| C. | 加热条件下,4.6g金属Na与足量O2反应的产物中阳离子和阴离子总数为0.3NA | |
| D. | 常温时,1 L0.1 mol•L-1的硝酸铵溶液中,NH4+和H+总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于0.5 mol | B. | 等于0.5 mol | C. | 大于0.5mol | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质质量的单位 | B. | 1 mol气体所占的体积一定是22.4L | ||
| C. | 1mol水质量为18g | D. | 氢气的摩尔质量是2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2--淡黄色固体,可作漂白剂 | |
| B. | Na2O--白色固体,性质不稳定加热可生成Na2O2 | |
| C. | NaCl--用于调味,医疗上作生理盐水 | |
| D. | Na2CO3--性质稳定,可用于治疗胃酸过多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com